Nội Dung Chính
Trang 40
MỤC TIÊU
- Trình bày được sự hình thành liên kết trong phúc chất theo thuyết liên kết hoá trị áp dụng cho phúc chất tứ diện và phức chất bát diện.
- Biểu diễn được dạng hình học của một số phức chất đơn giản.
- Viết được một số loại đồng phân cơ bản của phức chất: đồng phân cis-, trans-, đồng phân ion hóa, đồng phân liên kết.
MỞ ĐẦU
Trong phức chất [MLn], các phối tử L sắp xếp xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau. Vậy, sự hình thành liên kết trong phức chất tứ diện và phúc chất bát diện được giải thích như thế nào theo thuyết liên kết hóa trị.
I. LIÊN KẾT TRONG PHỨC CHẤT
Thuyết liên kết hoá trị giải thích sự hình thành liên kết hoa học giữa nguyên từ trung tâm M và phối tử L trong phức chất dựa trên các luận điểm cơ bản sau:
Liên kết hoá học giữa M và L trong phúc chất là liên kết cho - nhận. Phối tử cho cặp electron chưa liên kết vào orbital lai hoá trống của nguyên tử trung tâm.
Kiểu lai hóa của các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất
Bảng 8.1. Một số kiểu lại hoá của nguyên tử trung tâm và dạng hình học của phúc chất
| Phức chất [MLn] | Kiểu lai hóa của M | Hình ảnh các orbital lai hóa | Dạng hình học của phức chất |
| [ML4] | sp3 | 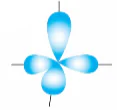 | Tứ diện |
| [ML6] | d2sp3 hoặc sp3d2 |  | Bát diện |
(Lưu ý: trong công thức [MLn], giả thiết phối tử L có dung lượng phối trí bằng 1, bỏ qua điện tích.)
Trang 41
EM CÓ BIẾT
L. Pauling (Pau-linh) không chỉ là nhà hoá học mà còn là nhà hoạt động vì hoà bình. Năm 1994, ông được trao giải Nobel hoá học, đến năm 1962 ông tiếp tục được trao giải Nobel hòa bình. Thuyết liên kết hoá trị (thuyết VB) của ông là thuyết lượng từ đầu tiên giải thích bản chất của liên kết hoá học trong phức chất.
Câu hỏi và bài tập
1. Xác định nguyên tử trung tâm và kiểu lai hoá của nó trong phức chất [Zn(NH3)4]2+ (có dạng hình học tứ diện) và phức chất [CoF6]3-.
2. Phức chất [CoCl2(en)2]+ có cấu tạo như sau:
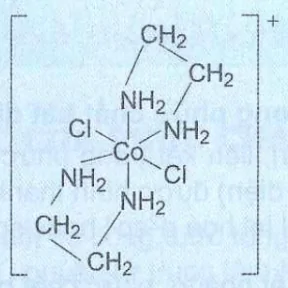
a) Chỉ ra các phối tử trong phức chất trên và dung lượng phối trị của chúng.
b) Chỉ ra nguyên tử trung tâm trong phức chất trên và số phối trí của nó.
c). Nguyên tử trung tâm trong phức chất trên đã nhận cặp electron từ nguyên tử nào của các phối tử?
d) Nêu dạng hình học của phức chất trên.
1. Sự hình thành liên kết trong phức chất tứ diện
Theo thuyết liên kết hoá trị, liên kết trong phức chất có dạng hình học tứ diện (còn được gọi là phức chất tứ diện) được hình thành từ sự cho cặp electron chưa liên kết của phối tử vào các orbital lai hoá sp3 trống của nguyên tử trung tâm.
Ví dụ: Theo thuyết liên kết hoá trị, phức chất tứ diện:
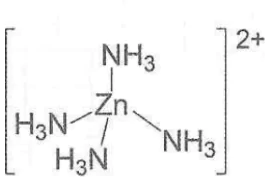
được hình thành như sau:
Nguyên tử trung tâm Zn2+ có cấu hình electron: [Ar]3d10.
Để tạo ra dạng hình học tứ diện, nguyên tử trung tâm Zn2+ lai hoá sp3, bốn phối từ NH3 cho cặp electron chưa liên kết của nguyên tử N vào bốn orbital lại hoá sp3 trống của Zn2+, tạo thành 4 liên kết σ.
Trang 42
Sự hình thành bốn liên kết σ này có thể được biểu diễn như sau:
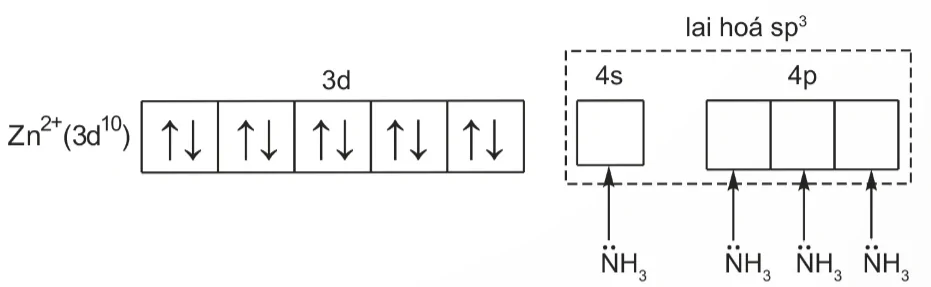
lai hoá sp3
Câu hỏi và bài tập
3. Biết phức chất [NiCl4]2- có dạng hình học từ diện
a) Xác định nguyên tử trung tâm và số phối trí của nguyên tử trung tâm.
b) Trình bày sự hình thành liên kết trong phức chất [NiCl4]2- theo thuyết liên kết hóa trị biết Ni có Z = 28.
2. Sự hình thành liên kết trong phức chất bát diện
Theo thuyết liên kết hoá trị, liên kết trong phức chất có dạng hình học bát diện (còn được gọi là phức chất bát diện) được hình thành từ sự cho cặp electron chưa liên kết của phối tử đến các orbital lai hóa d2sp3 hoặc sp3d2 trống của nguyên tử trung tâm.
Ví dụ 1: Theo thuyết liên kết hoá trị, phức chất bát diện:
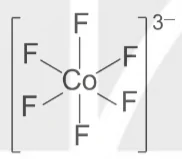
được hình thành như sau:
Nguyên từ trung tâm Co3+ có cấu hình electron: [Ar]3d6.
Để tạo ra dạng hình học bát diện, nguyên tử trung tâm Co3+ lai hóa sp3d2, sáu phối tử F- cho cặp electron chưa liên kết vào sáu orbital lai hóa sp3d2 trống của Co3+, tạo thành sáu liên kết σ.
Sự hình thành sáu liên kết σ này có thể được biểu diễn như sau:
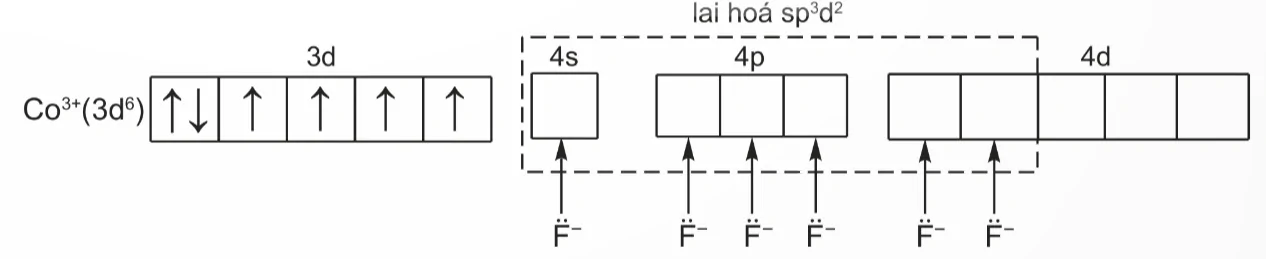
lai hoá sp3d2
Ví dụ 2: Theo thuyết liên kết hoá trị, phức chất bát diện:
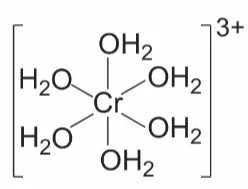
được hình thành như sau:
Trang 43
Nguyên tử trung tâm Cr3+ có cấu hình electron: [Ar]3d3.
Để tạo ra dạng hình học bát diện, nguyên tử trung tâm Cr3+ lai hóa d2sp3, sáu phối tử H2O cho cặp electron chưa liên kết của nguyên tử O vào sáu orbital lai hóa d2sp3 trống
của Cr3+, tạo thành sáu liên kết σ.
Sự hình thành sáu liên kết σ này có thể được biểu diễn như sau:
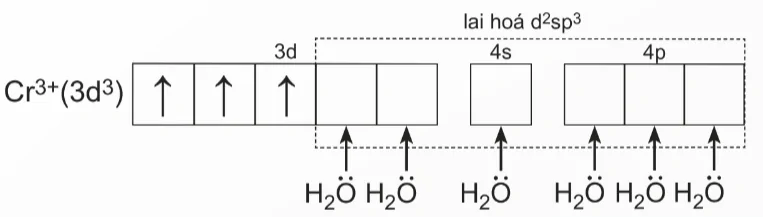
lai hóa d2sp3
Câu hỏi và bài tập
4. Dự đoán dạng hình học của phức chất [Ti(H2O)6]3+ và kiểu lai hóa của nguyên tử trung tâm trong phức chất, biết Ti có Z = 22.
5. Mô tả sự hình thành phức chất [FeF6]3- theo thuyết liên kết hoá trị. Biết Fe có 2 = 26.
II. BIỂU DIỄN DẠNG HÌNH HỌC CỦA PHỨC CHẤT
1. Phúc chất tử diện
Dạng hình học tứ diện của phức chất có công thức tổng quát [ML4] được biểu diễn ở Hình 8.1. Dạng hình học này mô tả nguyên tử trung tâm M ở tâm của hình tứ diện, bốn phối tử L nằm ở 4 đỉnh của hình tứ diện.

Hình 8.1. Dạng hình học tứ diện của phức chất: a) [ML4], b) [Zn(OH)4]2-
2. Phúc chất bát diện
Dạng hình học bát diện của phức chất có công thức tổng quát [ML6] được biểu diễn ở Hình 8.2. Dạng hình học này mô tả sáu phối tử L nằm ở sáu đỉnh của hình bát diện, M ở tâm hình bất diện.
Hầu hết các kim loại chuyển tiếp dãy thứ nhất có thể tạo phức chất bát diện, chẳng hạn các phức chất của Cr3+, Fe2+, Fe3+, Co3+ thưởng có dạng hình học bát diện.
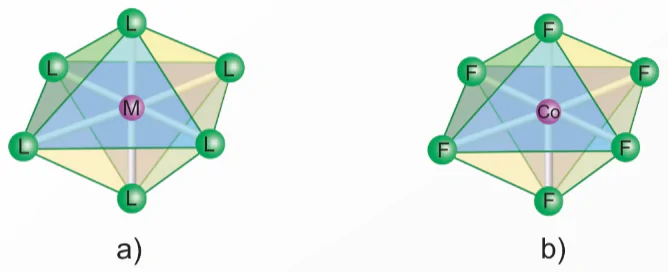
Hình 8.2. Dạng hình học bát diện của phức chất: a) [ML6], b) [CoF6]3-
Hoạt động nghiên cứu
Biểu diễn dạng hình học của phức chất tử diện [NiCL6]2- và phức chất bát diện [Fe(H2O)6]3+ .
Trang 44
III. MỘT SỐ ĐỒNG PHÂN CƠ BẢN CỦA PHỨC CHẤT
Phức chất có thể có một số loại đồng phân khác nhau như đồng phân cis-, trans-; đồng phân ion hóa; đồng phân liên kết.
1. Đồng phân cis-, trans-
Sự sắp xếp trong không gian của phối tử ở các vị trí khác nhau trong phức chất dẫn tới hiện tượng đồng phân cis-, trans- hay còn gọi là đồng phân hình học. Phức chất với hai phối tử giống nhau nằm cùng một phía đối với nguyên tử trung tâm được gọi là đồng phân cis-, khác phía đối với nguyên tử trung tâm được gọi là đồng phân trans-. Điều kiện cần để có các đồng phân cis-, trans- là trong phức chất phải có các loại phối tử khác nhau.
a) Phức chất vuông phẳng
Hoạt động nghiên cứu
Xét phức chất vuông phẳng có nguyên tử trung tâm M và hai loại phối tử A, B. Cả A và B đều có dung lượng phối trí là 1.
1. Viết các công thức hoá học có thể có của phức chất (bỏ qua diện tích của phức chất).
2. Biểu diễn dạng hình học có thể có của các phức chất.
Phức chất [MA2B2] có hai đồng phân là cis-, trans-.
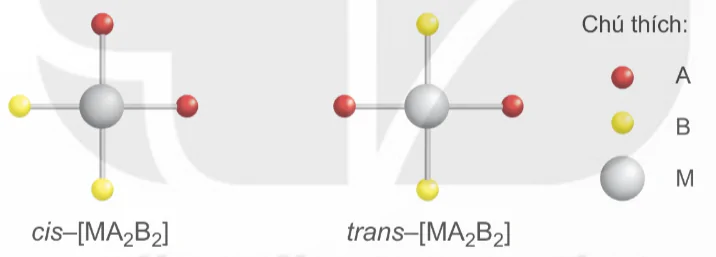
cis-[MA2B2]
trans-[MA2B2]
Chú thích: A, B, M
Ví dụ: Phức chất [PtCl2(NH3)2] có hai đồng phân cis-, trans- như sau:
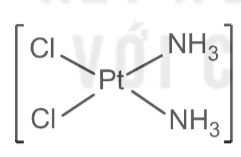
Dạng cis
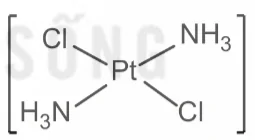
Dạng trans
EM CÓ BIẾT
Các phức chất [MA4] và [MAB3] không có đồng phân cis-, trans-.
Phức chất vuông phẳng [MA2BC] có đồng phân cis-, trans- như sau:
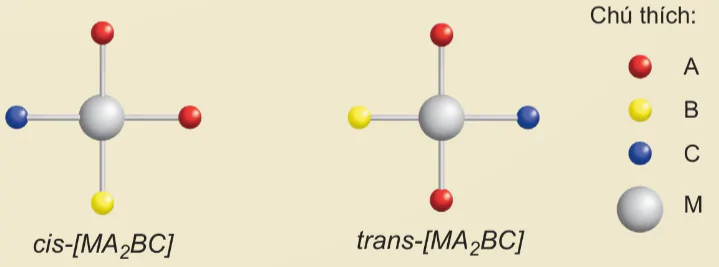
cis-[MA2BC]
trans-[MA2BC)
Chú thích: A, B, M
Các đồng phân cis-, trans- có tính chất và ứng dụng khác nhau, chẳng hạn phức chất cis-[PtCl2(NH3)2] có tác dụng chữa bệnh ung thư còn phức chất trans-[PtCl2(NH3)2] thì không.
Trang 45
Câu hỏi và bài tập
6. Cho các phức chất sau: [Ag(NH3)2]+, [ZnCl4]2-, [Ni(CN)4]2-, [PtCl2(NH3)2] (vuông phẳng).
a) Phức chất nào có đồng phân cis-, trans-?
b) Vẽ đồng phân cis-, trans- (nếu có) của mỗi phức chất.
b) Phức chất bát diện
Hoạt động nghiên cứu
Xét phức chất [MA4B2], trong đó phối tử A, B đều sử dụng lượng phối trí là 1.
1. Xác định số phối trí của nguyên tử trung tâm M và dạng hình học của phức chất.
2. Biểu diễn dạng hình học có thể có của phức chất.
Phúc chất [MA4B2] có hai đồng phân cis-, trans-.
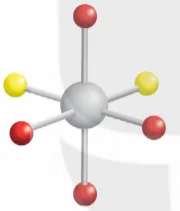
cis-[MA4B2]
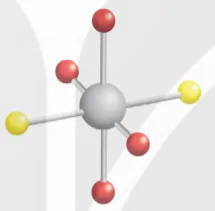
trans-[MA4B2]
Chú thích:
 A
A
 B
B
![]() M
M
Ví dụ: Phức chất [CoCl2(NH3)4]+ có hai đồng phân cis-, trans- như sau.
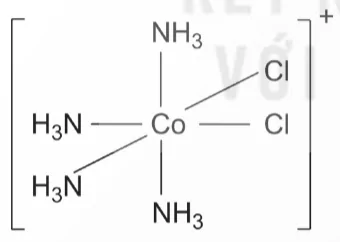
Dạng cis
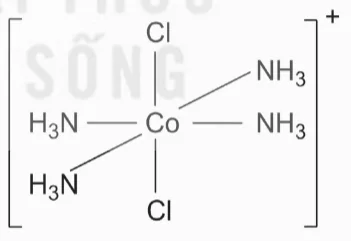
Dạng trans
Câu hỏi và bài tập
7. Cho phức chất: [Ni(NH3)6]2+ và [PdCl2(NH3)4]
a) Phức chất nào có đồng phân cis-, trans-?
b) Vẽ đồng phân cis-, trans- (nếu có) của mỗi phức chất.
Trang 46
2. Đồng phân liên kết
Đồng phân liên kết có thể xuất hiện khi phối tử có hai hay nhiều nguyên tử có khả năng tạo liên kết cho – nhận với nguyên tử trung tâm.
Ví dụ: phối tử NO2- có thể liên kết với nguyên tử trung tâm M qua nguyên tử O hoặc nguyên từ N. Để chỉ rõ NO2-, liên kết với nguyên tử trung tâm qua nguyên tử O hay nguyên tử N, trong công thức của phức chất, người ta viết phối tử này là (ONO) hay (NO2) tương ứng. Phức chất chứa phối tử NO2- có thể có hai đồng phân liên kết như sau:
[MLx(ONO)]: phối tử NO2- liên kết với M qua nguyên tử O.
(MLx(NO2)]; phối tử NO2- liên kết với M qua nguyên tử N.
Câu hỏi và bài tập
8. Phức chất (A) và phức chất (B) có cấu tạo như sau:
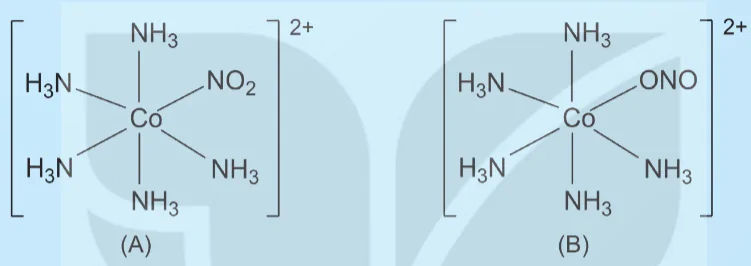
Hãy chỉ ra sự khác nhau về cấu tạo của hai phức chất này.
3. Đồng phân ion hóa
Đồng phân ion hoá của phức chất có thành phần trong cầu nội và cầu ngoại khác nhau, xảy ra do có sự trao đổi phối tử mang diện tích âm trong cầu nội với anion ở cầu ngoại.
Ví dụ: Anion SO42- ở cầu ngoại của phức chất [CoBr(NH3)5](SO4) trao đổi với phối tử Br- trong cầu nội, tạo thành phức chất [Co(NH3)5(SO4)]Br. Do vậy phức chất [CoBr(NH3)5](SO4) và [Co(NH3)5(SO4)]Br là hai đồng phân ion hóa của nhau.
EM CÓ BIẾT
Sự khác nhau của các đồng phân ion hoá
Trong dung dịch, đồng phân ion hoá phân li ra các ion khác nhau và thường cho màu sắc khác nhau.
Ví dụ: Hai đồng phân ion hóa [CoBr(NH3)5](SO4) và [Co(NH3)5(SO4)]Br có màu tím và đỏ tương ứng: trong cung dịch, chúng phân li như sau:
[CoBr(NH3)5](SO4) → [CoBr(NH3)5]2+ + SO42-
[Co(NH3)5(SO4)]Br → [Co(NH3)5(SO4)]+ + Br-
Trang 47
EM ĐÃ HỌC
• Theo thuyết liên kết hoá trị, trong phúc chất [MLn], phối tử L cho cặp electron chưa liên kết vào orbital lại hoá trống của nguyên tử trung tâm M tạo thành liên kết ở kiểu cho – nhận.
• Biểu diễn dạng hình học của phức chất tứ diện và bát diện.
• Ba loại đồng phân cơ bản của phức chất là đồng phân cis-, trans-, đồng phân liên kết và đồng phân ion hóa.
EM CÓ THỂ
• Mô tả được sự hình thành liên kết của một số phức chất tứ diện và bát diện theo thuyết liên kết hoá trị.
• Biểu diễn được dạng hình học của một số phức chất dạng tứ diện và bát diện. Xác định được đồng phân cis−, trans-, đồng phân liên kết, đồng phân ion hoá của một số phức chất.



































































Bình Luận
Để Lại Bình Luận Của Bạn