Nội Dung Chính
Mở đầu trang 30 Hóa học 10: Bảng tuần hoàn các nguyên tố hóa học có cấu tạo như thế nào? Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào?
Lời giải:
- Cấu tạo bảng tuần hoàn các nguyên tố hóa học gồm có: ô nguyên tố, chu kì và nhóm.
- Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
I. Lịch sử phát minh bảng tuần hoàn các nguyên tố hóa học
Câu hỏi 1 trang 31 Hóa học 10: Theo tiến trình lịch sử, các nhà khoa học đã phân loại các nguyên tố hóa học dựa trên các cơ sở nào?
Lời giải:
- Năm 1789, A. Lavoisier xếp 33 nguyên tố hóa học thành nhóm các chất khí, kim loại, phi kim và “đất”.
- Năm 1829, Đô – be -rai – nơ phân loại các nguyên tố thành các nhóm có tính chất hóa học giống nhau.
- Năm 1866, J. Newlands đã xếp các nguyên tố hóa học theo chiều tăng của khối lượng nguyên tử thành các octave (quãng tám), trong đó nguyên tố thứ 8 lặp lại tính chất của nguyên tử đầu tiên.
- Năm 1869, hai nhà hóa học, D. I. Mendeleev và J. L. Meyer đã sắp xếp các nguyên tố theo chiều tăng khối lượng nguyên tử vào các hàng và cột, bắt đầu mỗi hàng (bảng của Mendeleev) hoặc cột mới (bảng của Meyer) khi các tính chất của nguyên tố bắt đầu lặp lại.
II. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Câu hỏi 2 trang 31 Hóa học 10: Trong bảng tuần hoàn, các nguyên tố hóa học được sắp xếp theo ba nguyên tắc, nguyên tắc nào sau đây là đúng?
A. Nguyên tử khối tăng dần.
B. Cùng số lớp electron xếp cùng cột.
C. Điện tích hạt nhân tăng dần.
D. Cùng số electron hóa trị xếp cùng hàng.
Lời giải:
Đáp án C
Trong bảng tuần hoàn, các nguyên tố hóa học được sắp xếp theo ba nguyên tắc:
- Các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
III. Cấu tạo của bảng tuần hoàn
Câu hỏi 3 trang 33 Hóa học 10: Ô nguyên tố trong bảng tuần hoàn cho ta biết những thông tin gì? Lấy ví dụ minh họa.
Lời giải:
Tùy theo từng loại bảng tuần hoàn, ô nguyên tố có thể cho biết số hiệu nguyên tử, kí hiệu nguyên tố, tên nguyên tố, nguyên tử khối trung bình, …
Ví dụ: Ô nguyên tố số 13
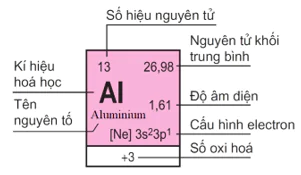
Câu hỏi 4 trang 33 Hóa học 10: Dựa vào bảng tuần hoàn, hãy cho biết cấu hình electron và số electron hóa trị của các nguyên tố: C, Mg và Cl.
Lời giải:
Dựa vào bảng tuần hoàn, ta xác định được:
- Nguyên tố C có cấu hình electron là 1s2 2s2 2p2. C thuộc nhóm A, lớp ngoài cùng có 4 electron nên số electron hóa trị bằng 4.
- Nguyên tố Mg có cấu hình electron là 1s2 2s2 2p6 3s2. Mg thuộc nhóm A, lớp ngoài cùng có 2 electron nên số electron hóa trị bằng 2.
- Nguyên tố Cl có cấu hình electron là 1s2 2s2 2p6 3s2 3p5. Cl thuộc nhóm A, lớp ngoài cùng có 7 electron nên số electron hóa trị bằng 7.
Câu hỏi 5 trang 33 Hóa học 10: Dựa vào bảng tuần hoàn, hãy cho biết: 12Mg, 15P, 26Fe, 18Ar thuộc loại nguyên tố nào sau đây.
a) s, p, d hay f?
b) phi kim, kim loại hay khí hiếm?
Lời giải:
a) Dựa vào bảng tuần, các nguyên tố 12Mg, 15P, 26Fe, 18Ar lần lượt thuộc loại nguyên tố s, p, d, p.
Giải thích:
Mg thuộc nhóm IIA nên là nguyên tố s.
P thuộc nhóm VA, Ar thuộc nhóm VIIIA nên là nguyên tố p.
Fe thuộc nhóm VIIIB nên là nguyên tố d.
b) Dựa vào bảng tuần hoàn, xác định: nguyên tố Mg, Fe là kim loại; nguyên tố P là phi kim; nguyên tố Ar là khí hiếm.
Câu hỏi 6 trang 33 Hóa học 10: Nguyên tố phosphorus có Z = 15, có trong thành phần của một loại phân bón, diêm, pháo hoa; nguyên tố calcium có Z = 20, đóng vai trò rất quan trọng đối với cơ thể, đặc biệt là xương và răng. Xác định vị trí của hai nguyên tố trên trong bảng tuần hoàn và cho biết chúng thuộc loại nguyên tố s, p hay d; là kim loại, phi kim hay khí hiếm.
Lời giải:
- Nguyên tố phosphorus (P) có Z = 15 nên nguyên tử có 15 electron.
⇒ Cấu hình electron nguyên tử là 1s2 2s2 2p6 3s2 3p3.
⇒ Nguyên tử P có 3 lớp electron và electron lớp ngoài cùng là 5.
⇒ Nguyên tố phosphorus là phi kim, thuộc ô thứ 15, chu kì 3, nhóm VA, nguyên tố p.
- Nguyên tố calcium (Ca) có Z = 20 nên nguyên tử có 20 electron.
⇒ Cấu hình electron nguyên tử Ca là 1s2 2s2 2p6 3s2 3p6 4s2.
⇒ Nguyên tử có 4 lớp electron và electron lớp ngoài cùng là 2.
⇒ Nguyên tố calcium là kim loại, thuộc ô thứ 20, chu kì 4, nhóm IIA, nguyên tố s.
Câu hỏi 7 trang 33 Hóa học 10: Sulfur (lưu huỳnh) là chất rắn, xốp, màu vàng nhạt ở điều kiện thường. Sulfur và hợp chất của nó được sử dụng trong acquy, bột giặt, thuốc diệt nấm; do dễ cháy nên sulfur còn được dùng để sản xuất các loại diêm, thuốc súng, pháo hoa, … Trong bảng tuần hoàn, nguyên tố sulfur nằm ở chu kì 3, nhóm VIA.
a) Nguyên tử của nguyên tố sulfur có bao nhiêu electron thuộc lớp ngoài cùng?
b) Các electron lớp ngoài cùng thuộc những phân lớp nào?
c) Viết cấu hình electron nguyên tử của sulfur.
d) Sulfur là nguyên tố kim loại hay phi kim?
Lời giải:
a) Trong bảng tuần hoàn, nguyên tố sulfur nằm ở chu kì 3, nhóm VIA.
⇒ Nguyên tử của nguyên tố sulfur có 6 electron thuộc lớp ngoài cùng (lớp thứ 3).
b) Sự phân bố electron lớp ngoài cùng là 3s2 3p4.
⇒ Các electron lớp ngoài cùng thuộc phân lớp 3s và 3p.
c) Cấu hình electron nguyên tử của sulfur là 1s2 2s2 2p6 3s2 3p4.
d) Lớp ngoài cùng có 6 electron nên sulfur là phi kim.
Em có thể trang 33 Hóa học 10: Xác định được vị trí các nguyên tố hóa học trong bảng tuần hoàn và phân loại được thành phần nguyên tố s, p, d, f hay nguyên tố kim loại, phi kim, khí hiếm.
Lời giải:
- Để xác định được vị trí các nguyên tố hóa học trong bảng tuần hoàn cần biết:
+ Số electron của nguyên tử ⇒ xác định được ô nguyên tố.
+ Số lớp electron của nguyên tử ⇒ xác định được chu kì.
+ Số electron hóa trị ⇒ xác định được nhóm.
- Phân loại thành phần nguyên tố: các nguyên tố s, p, d, f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s, p, d, f tương ứng.
- Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
+ Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
+ Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
+ Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.






































































Bình Luận
Để Lại Bình Luận Của Bạn