Nội Dung Chính
(Trang 5)
MỤC TIÊU
- Viết được công thức Lewis, sử dụng được mô hình VSEPR để dự đoán dạng hình học của một số phân tử đơn giản.
- Trình bày được khái niệm về sự lai hoá AO (sp, sp2, sp3), vận dụng giải thích liên kết trong một số phân tử.
| ? Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực,... của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một số phân tử? |
I. CÔNG THỨC LEWIS
1. Công thức electron, công thức Lewis
Công thức electron
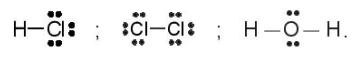
Khi biểu diễn liên kết giữa các nguyên tử bằng một hay nhiều cặp electron dùng chung, ta được công thức electron.
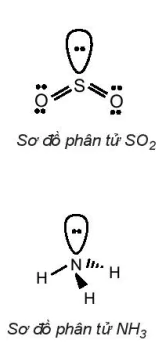
Ví dụ: Công thức electron của các phân tử HCl, Cl2, H2O lần lượt là:

Công thức Lewis:
Khi thay mỗi cặp electron dùng chung trong công thức electron bằng một gạch nối (–), ta được công thức Lewis.
Ví dụ: Công thức Lewis của các phân tử HCl, Cl2, H2O lần lượt là:
2. Các bước viết công thức Lewis
Bước 1. Xác định tổng số electron hoá trị trong phân tử.
Tổng số electron hoá trị trong phân tử bằng tổng số electron hoá trị của tất cả các nguyên tử trong phân tử.
Ví dụ: Xét phân tử CO2, tổng số electron hoá trị = 1·4 + 2·6 = 16 electron.
(Trang 6)
Bước 2. Vẽ khung phân tử với các liên kết đơn. Trong đó, nguyên tử trung tâm thường là nguyên tử cần nhiều electron nhất để đạt octet, các nguyên tử còn lại xếp xung quanh nguyên tử trung tâm.
Trong phân tử CO2, nguyên tử C cần 4 electron để đạt octet, nguyên tử O cần 2 electron hoá trị để đạt octet. Vì vậy, C là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh:
O – C – O
Bước 3. Điền các electron hoá trị chưa tham gia liên kết vào các nguyên tử xung quanh để đạt octet.
Mỗi nguyên tử O cần 6 electron hoá trị để đạt octet: :
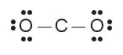
Bước 4. Tính số electron hoá trị còn lại. Nếu còn các electron hoá trị thì sử dụng để hoàn thành octet của nguyên tử trung tâm. Nếu số electron hoá trị đã hết mà nguyên tử trung tâm chưa đạt octet thì chuyển các cặp electron hoá trị từ nguyên tử xung quanh để tạo liên kết đôi hoặc liên kết ba với nguyên tử trung tâm, sao cho phù hợp với hoá trị của nguyên tố.
– Trong phân tử CO2, số electron hoá trị còn lại là: 16 – 2·2 – 2·6 = 0.
– Số electron hoá trị của nguyên tử C là 4, nên để đạt octet mỗi nguyên tử O dùng 1 cặp electron hoá trị để tạo liên kết đôi với nguyên tử C.
Công thức Lewis của phân tử CO2: :
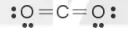
Ví dụ: Viết công thức Lewis của phân tử PCl3.
(1) Tổng số electron hoá trị trong phân tử: 1·5 + 3·7 = 26.
(2) Vẽ khung phân tử PCl3:
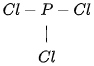
(3) Hoàn thiện octet cho các nguyên tử Cl:
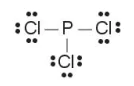
(4) Tính số electron hoá trị còn lại: 26 – 3·2 – 3·6 = 2.
Chuyển 2 electron còn lại vào nguyên tử P để đạt octet, thu được công thức Lewis của phân tử PCl3:
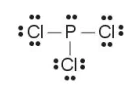
Lưu ý: Trong một số trường hợp nguyên tử trung tâm có thể có số lẻ electron, hoặc nhiều hơn 8 electron.
(Trang 7)
| ? 1. Công thức Lewis của CS2 là:
2. Trình bày các bước để viết công thức Lewis của phân tử NH3. 3. Viết các công thức Lewis cho mỗi phân tử sau: a) Cl2; N2 b) SO2; SO3 c) H2O; H2S; HOCl 4. Công thức Lewis của NO2 là
|
II. CẤU TRÚC HÌNH HỌC CỦA MỘT SỐ PHÂN TỬ
1. Mô hình VSEPR (mô hình lực đẩy giữa các cặp electron hoá trị)
Liên kết cộng hoá trị được tạo thành bởi sự dùng chung các cặp electron. Các cặp electron này phân bố trong vùng không gian giữa hai hạt nhân nguyên tử tạo nên liên kết. Liên kết cộng hoá trị có tính định hướng không gian nên phân tử có hình dạng nhất định.
Công thức Lewis cho biết cấu tạo của phân tử nhưng không cho biết dạng hình học của phân tử. Mô hình VSEPR (Valence Shell Electron Pair Repulsion) được sử dụng để mô tả dạng hình học của các phân tử dựa trên lực đẩy giữa các cặp electron hoá trị.
"Các cặp electron hoá trị được phân bố xung quanh nguyên tử trung tâm sao cho lực đẩy giữa chúng là nhỏ nhất".
Để sử dụng mô hình VSEPR, công thức phân tử của chất được viết dưới dạng AXnEm.
Trong đó:
A: nguyên tử trung tâm;
X: nguyên tử liên kết với nguyên tử A; n là số nguyên tử;
E: cặp electron hoá trị chưa liên kết của nguyên tử A; m là số cặp electron;
Nếu nguyên tử trung tâm là một electron thì electron đó vẫn được tính tương đương một cặp electron.
Ví dụ: Công thức phân tử của methane viết theo mô hình VSEPR là CH4.
Công thức phân tử của ammonia viết theo mô hình VSEPR là NH3E.
Công thức phân tử của nước viết theo mô hình VSEPR là OH2E2.
(Trang 8)
2. Hình dạng một số phân tử và ion
| a) Trường hợp AXn (với n = 2, 3, 4,...) Với n = 2 (AX2): Xung quanh nguyên tử trung tâm A không có các cặp electron chưa liên kết, chỉ có hai cặp electron liên kết đẩy nhau, nên góc hoá trị lớn nhất là 180o, hai cặp electron liên kết được phân bố tròn đường thẳng, phân tử có cấu trúc thẳng. Ví dụ: BeH2, BeCl2, CO2,... Với n = 3 (AX3): Xung quanh nguyên tử trung tâm A có ba cặp electron liên kết đẩy nhau, nên góc hoá trị lớn nhất là 120o. Ba cặp electron được phân bố trên mặt phẳng vuông về ba đỉnh của tam giác, phân tử có cấu trúc tam giác phẳng. Ví dụ: BF3, SO3,... Với n = 4 (AX4): Xung quanh nguyên tử trung tâm A có bốn cặp electron liên kết đẩy nhau để góc hoá trị lớn nhất là 109,5o. Bốn cặp electron được phân bố hướng về bốn đỉnh của tứ diện, phân tử có cấu trúc tứ diện. Ví dụ: CH4, NH4+, SO42-, PO43-... b) Dự đoán dạng hình học của một số trường hợp AXnEm Các electron độc thân, cặp electron chưa liên kết chiếm khoảng gian lớn hơn so với cặp electron liên kết, làm giảm giảm góc liên kết của phân tử. Các nguyên tử xung quanh có độ âm điện lớn hơn hút cặp electron liên kết mạnh hơn, làm giảm góc liên kết của phân tử.
|
|
(Trang 9)
| Phân tử H2O: Xung quanh nguyên tử trung tâm O có hai cặp electron chưa liên kết, công thức VSEPR của H2O là AX2E2. Do cặp electron chưa liên kết chiếm khoảng không gian lớn hơn so với cặp electron liên kết, tương tác đẩy giữa cặp electron chưa liên kết lớn hơn tương tác đẩy giữa các cặp electron liên kết, nên góc liên kết | 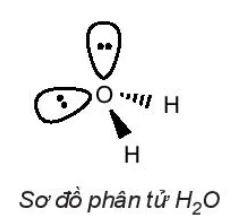 |
| ? 5. Công thức của PCl3 theo mô hình VSEPR là A. AX3. B. AXE2. C. AX3E. D. AX2E. 6. Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hoá trị liên kết và chưa liên kết trong mỗi phân tử. 7. Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không? 8. Dạng hình học của ion NH4+ là A. Tứ diện đều. B. Tháp tam giác. C. Tam giác phẳng. D. Đường thẳng. 9. Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2. |
III. SỰ LAI HOÁ ORBITAL NGUYÊN TỬ
1. Khái niệm lai hoá orbital
Khi sử dụng sự xen phủ các orbital nguyên tử tạo thành liên kết hoá học, không giải thích được góc liên kết ở một số trường hợp. Ví dụ: nếu đưa vào sự xen phủ các orbital 1s của nguyên tử H với các orbital 2s và 2p của nguyên tử C trong phân tử CH4 thì các góc liên kết ![]()
Để giải thích điều này, có thể sử dụng khái niệm "lai hoá orbital". Các orbital của cùng một nguyên tử có năng lượng gần nhau có thể "tổ hợp" với nhau tạo ra orbital mới có hình dạng giống nhau và có năng lượng bằng nhau nhưng định hướng khác nhau trong không gian, gọi là orbital lai hoá. Số orbital lai hoá được hình thành bằng tổng số orbital tham gia lai hoá.
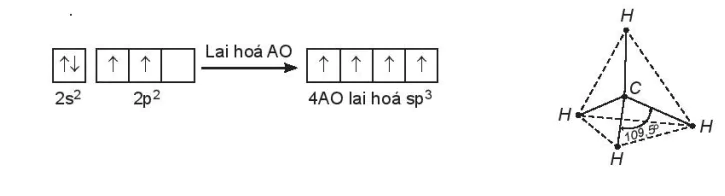
Ví dụ: Áp dụng lai hoá orbital để giải thích góc liên kết trong phân tử CH4.
Cấu hình electron hoá trị của nguyên tử C: 2s22p2. Một orbital 2s tổ hợp với ba orbital 2p tạo ra bốn orbital lai hoá hoàn toàn giống nhau, hướng về bốn đỉnh của tứ diện đều. Bốn orbital lai hoá này xen phủ với các orbital 1s của bốn nguyên tử H, tạo ra bốn liên kết σ (C – H), nên góc liên kết ![]() trong tứ diện đều (có nguyên tử C ở tâm) bằng 109,5o.
trong tứ diện đều (có nguyên tử C ở tâm) bằng 109,5o.
(Trang 10)
2. Một số trạng thái lai hoá cơ bản
a) Lai hoá sp3
Một AO s tổ hợp với ba AO p trong một nguyên tử tạo ra bốn AO lai hoá sp3, hướng về bốn đỉnh của một tứ diện đều mà tâm của hình tứ diện là hạt nhân nguyên tử đang xét. Góc tạo bởi hai trục của hai AO kề nhau là 109,5o. Lai hoá sp3 còn được gọi là lai hoá tứ diện.
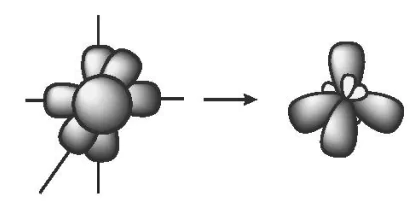
Ví dụ: Phân tử nitrogen trifluoride NF3.
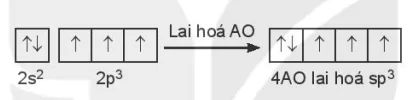
Cấu hình electron hoá trị của N: 2s22p3.
Trong nguyên tử N, một AO 2s lai hoá với ba AO 2p, tạo ra bốn AO lai hoá sp3.
Ba AO lai hoá sp3 (chứa electron độc thân) của nguyên tử N xen phủ với AO 2p của nguyên tử fluorine, tạo thành ba liên kết σ hướng về ba đỉnh của hình tứ diện. Nguyên tử nitrogen còn một AO lai hoá sp3 chứa một cặp electron chưa liên kết nằm hướng về đỉnh còn lại của hình tứ diện.
b) Lai hoá sp2
Một AO s tổ hợp với hai AO p trong một nguyên tử, tạo ra ba AO lai hoá sp2 hướng về ba đỉnh của một tam giác đều. Ba AO này cùng nằm trong một mặt phẳng, góc tạo bởi hai trục của hai AO kề nhau là 120o. Lai hoá sp2 còn được gọi là lai hoá tam giác phẳng.
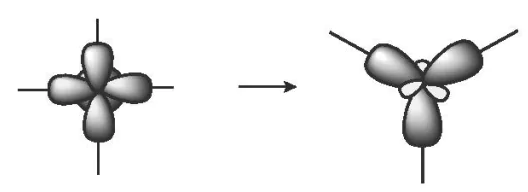
(Trang 11)
Ví dụ: Phân tử boron trifluoride BF3.
Cấu hình electron hoá trị của B: 2s22p1.
Trong nguyên tử B, một AO 2s lai hoá với hai AO 2p, tạo ra ba AO lai hoá sp2.
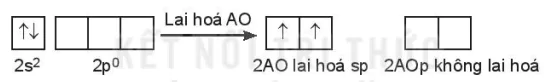
Ba AO lai hoá sp2 của nguyên tử B xen phủ với ba AO 2p (chứa electron độc thân) của ba nguyên tử fluorine, tạo thành ba liên kết σ hướng về ba đỉnh của tam giác đều; giải thích cho dự đoán dạng hình học của phân tử BF3 (dạng AX3) theo mô hình VSEPR. Trong phân tử BF3 còn có một liên kết π.
c) Lai hoá sp
Một AO s tổ hợp với một AO p trong một nguyên tử tạo ra hai AO lai hoá sp, góc tạo bởi hai AO lai hoá là 180o. Lai hoá sp còn được gọi là lai hoá thẳng.

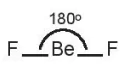
Ví dụ: Phân tử beryllium Fluoride BeF2.
Cấu hình electron hoá trị của Be: 2s2.
Trong nguyên tử Be, một AO 2s tổ hợp với một AO 2p, tạo ra hai AO lai hoá sp.
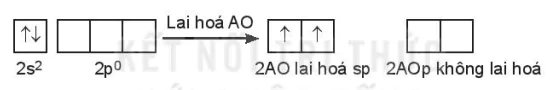
Hai AO lai hoá sp của nguyên tử Be xen phủ với hai AO p của hai nguyên tử F tạo thành hai liên kết σ hướng về hai phía của một đường thẳng, góc liên kết là 180o; giải thích cho dự đoán dạng hình học của phân tử BeF2 (dạng AX2) theo mô hình VSEPR.
| EM CÓ BIẾT Nguyên tử carbon có thể có cả ba trạng thái lai hoá trên. Ví dụ: Lai hoá sp3 trong trường hợp nguyên tử C có liên kết đơn (CH3–CH3); Lai hoá sp2 trong trường hợp nguyên tử C có liên kết đôi (CH2=CH2); Lai hoá sp trong trường hợp nguyên tử C có liên kết ba (CH≡CH). |
(Trang 12)
| ? 10. Các nguyên tử carbon (1), (2), (3) trong hình bên ở những trạng thái lai hoá nào?
11. Mô tả sự tạo thành các phân tử sau theo khái niệm lai hoá orbital. a) Phân tử BeH2 b) Phân tử SO2 c) Phân tử NH3 12. Cho các phân tử NCl3, SO3, CO2. a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hoá nào? b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao? |
| EM ĐÃ HỌC
|
| EM CÓ THỂ Vận dụng công thức phân tử theo mô hình VSEPR để dự đoán dạng hình học và vận dụng khái niệm lai hoá orbital để giải thích dạng hình học đã dự đoán theo công thức phân tử theo mô hình VSEPR. |

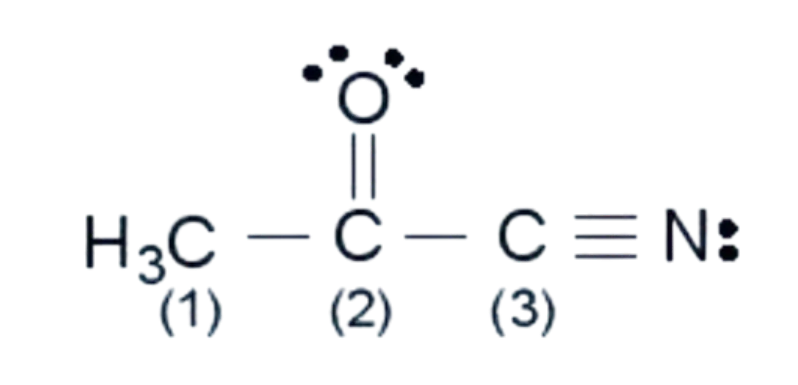





































































Bình Luận
Để Lại Bình Luận Của Bạn