Nội Dung Chính
(Trang 24)
MỤC TIÊU
- Nêu được khái niệm về entropy.
- Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs (
 ,G0).
,G0). - Tính được
 , G0 từ bảng cho sẵn các giá trị
, G0 từ bảng cho sẵn các giá trị  , H0 và S0 của các chất.
, H0 và S0 của các chất.
| ? Dựa vào đại lượng nào để dự đoán phản ứng hoá học có thể xảy ra được hay không? |
I. ENTROPY
1. Entropy và mức độ mất trật tự trong hệ vĩ mô
Entropy (kí hiệu là S) là thước đo mức độ hỗn loạn (mất trật tự) của hệ chứa số lượng lớn hạt như nguyên tử, phân tử hoặc ion. Entropy gắn với độ tự do trong chuyển động của các phân tử, độ tự do chuyển động càng cao thì entropy càng lớn. Đối với một chất, entropy ở thể khí lớn hơn ở thể lỏng, ở thể lỏng lớn hơn ở thể rắn. Khi chuyển chất từ thể khí sang thể lỏng và sang thể rắn, mức độ tự do chuyển động giảm và về tốc độ và hướng chuyển động) nên entropy giảm. Ngược lại, khi chất rắn nóng chảy (hay thăng hoa) và khi chất lỏng sôi (bay hơi), chuyển động hỗn loạn của các hạt tăng, làm tăng entropy của hỗn hợp.
Người ta quy ước một chất rắn lí tưởng ở độ không tuyệt đối (0 K) có entropy bằng 0.
Người ta đã xác định được entropy cho các chất thông dụng ở điều kiện chuẩn: 298 K và 1 bar, được kí hiệu 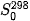 (đơn vị thường là J-mol-1.K-1) (xem Bảng 4.1).
(đơn vị thường là J-mol-1.K-1) (xem Bảng 4.1).
2. Biến thiên entropy trong phản ứng hoá học
Khi phản ứng hoá học xảy ra, biến thiên entropy của phản ứng được tính bằng tổng entropy của các chất sản phẩm phản ứng (viết tắt là sp) trừ đi tổng entropy của các chất tham gia phản ứng (viết tắt là cđ).
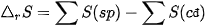
Ở điều kiện chuẩn (298 K, 1 bar):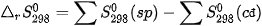
Các phản ứng hoá học làm tăng số mol khí thường có biến thiên entropy dương (ΔS > 0), các phản ứng làm giảm số mol khí thường có biến thiên entropy âm (ΔS < 0), các phản ứng hoá học không làm thay đổi số mol khí hoặc phản ứng không có chất khí sẽ có biến thiên entropy nhỏ.
(Trang 25)
Ví dụ 1: Phản ứng khử:
CO2(g) + C(graphite) → 2CO(g)
Từ 1 mol khí CO2 tạo ra 2 mol khí CO, nên số mol khí tăng.
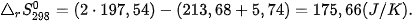
Ví dụ 2: Phản ứng oxi hoá:
2H2(g) + O2(g)→ 2H2O(g)
Từ 3 mol khi (H2 + O2) tạo ra 2 mol khí H2 nên số mol khí giảm.
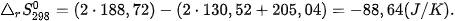
Ví dụ 3: C(graphite) + O2(g)→ CO2(g).
Từ 1 mol khí O2 tạo ra 1 mol khí CO2, nên số mol khí không đổi.
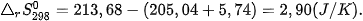
| ? 1. Dãy nào dưới đây các chất sắp xếp theo chiều tăng giá trị entropy chuẩn? A. CO2(s) < CO2(l) < CO2(g). B. CO2(g) < CO2(l) < CO2(s). C. CO2(s) < CO2(g) < CO2(l). D. CO2(g) < CO2(s) < CO2(l). 2. Phản ứng nào dưới đây xảy ra kèm theo sự giảm e u giám entropy? A. N2(g) + O2(g) →2NO(g). B. N2O4(g) →2NO2(g). C. 2CO(g) → C(s) + CO2(g). D. 2HCI(aq) + Fe(s) →FeCI2(aq) + H2(g). 3. Biến thiên entropy chuẩn của phản ứng nào dưới đây có giá trị dương? A. Ag+(aq) + Br-(aq)→ AgBr(s). B. 2C2H6(g) + 3O2(g) →4CO2(g) + 6H2O(l). C. N2(g) + 2H2(g)→ N2H4(g). D. 2H2O2(l)→ 2H2O(l) + O2(g). 4. Dựa vào dữ liệu ở Bảng 4.1, tính biến thiên entropy chuần của các phản ứng: a) 4Fe(s) +3O2(g) →2Fe2O3(s) b) SO2 (g)+ |
(Trang 26)
II. NĂNG LƯỢNG TỰ DO GIBBS
Trong tự nhiên, các quá trình tự diễn biến thường có xu hướng: làm giảm enthalpy (ΔH < 0), làm tăng entropy (ΔS > 0). Khi xét quá trình hoá học có tự xảy ra hay không phải xét đồng thời cả biến thiên enthalpy và biến thiên entropy, thông qua biến thiên năng lượng Gibbs (ΔG) (ở nhiệt độ và áp suất không đổi).
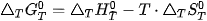
Trong đó:
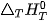 Hệ là biến thiên enthalpy chuần của phản ứng ở nhiệt độ T
Hệ là biến thiên enthalpy chuần của phản ứng ở nhiệt độ T
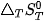 là biến thiên entropy chuần của phản ứng ở nhiệt độ T.
là biến thiên entropy chuần của phản ứng ở nhiệt độ T.
T là nhiệt độ tại đó xảy ra phản ứng (theo thang Kelvin);
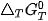 là biến thiên năng lượng tự do Gibbs chuần của phản ứng ở nhiệt độ T.
là biến thiên năng lượng tự do Gibbs chuần của phản ứng ở nhiệt độ T.
Dựa vào 4, G có thể dự đoán hoặc giải thích được chiều hướng của một phản ứng hoá học ở nhiệt độ T:
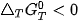 phản ứng sẽ tự xảy ra, giá trị
phản ứng sẽ tự xảy ra, giá trị 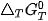
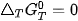 phản ứng đạt trạng thái cân bằng.
phản ứng đạt trạng thái cân bằng.
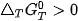 phản ứng không tự xảy ra.
phản ứng không tự xảy ra.
Bảng 4.1. Giá trị entropy chuẩn và enthalpy hình thành chuẩn của một số chất (*)
| Chất | 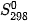 (J/mol-K) (J/mol-K) | 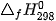 (KJ/mol) (KJ/mol) | Chất | 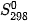 | 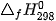 (kJ/mol) (kJ/mol) |
| C(graphite) | 5.7 | - | H2(g) | 130,6 | - |
| CO(g) | 197,5 | -110,5 | H2O(g) | 188,7 | -241,8 |
| CO2(g) | 213,7 | -393,5 | NO(g) | 210,7 | 90,3 |
| CaO(s) | 38,2 | -635,1 | NO2(g) | 239,9 | 33,2 |
| CaCO3(s) | 92,9 | -1206,9 | N2O4(g) | 304,3 | 9,2 |
| Fe(s) | 27,3 | - | O2(g) | 205 | - |
| Fe2O3(s) | 87,4 | -825,5 | S(g) | 168 | 279 |
| KCI(s) | 82,6 | -436,7 | SO2(g) | 248,1 | -296,8 |
| KCIO3(s) | 143,1 | -397,7 | SO3(g) | 256,7 | -396,0 |
Ví dụ 1: Phản ứng 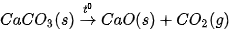 ở 298 K và 1 bar
ở 298 K và 1 bar
có 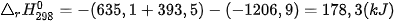
và 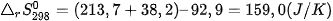
nên 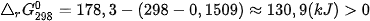
Như vậy, ở điều kiện chuẩn (25 °C, 1 bar), CaCO3 không bị phân huỷ.
(*) Nguồn: Silberberg, Martin. (2018). Chemistry: the molecular nature of matter and change with advanced topics. McGraw-Hill Education.
(Trang 27)
Vĩ dụ 2: Phản ứng 2NO(g) +O2(g) →2NO2(g) ở 298K và 1 bar.
Có 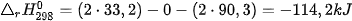
và 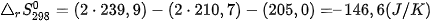
nên 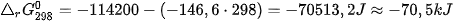
⇒Phån ứng tự xảy ra ở 298K.
| ? 5. Phản ứng phân huỷ của potassium chlorate:
Dựa vào các giá trị của 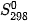 ở Bảng 4.1 đề tính toán và cho biết ở điều kiện chuẩn phản ứng có khả năng tự xảy ra không? ở Bảng 4.1 đề tính toán và cho biết ở điều kiện chuẩn phản ứng có khả năng tự xảy ra không? 6. Dựa vào các giả trị của 3C(graphite) + 2Fe2O3(s) →4Fe(s) + 3CO2(g) |
| EM ĐÃ HỌC
|
| EM CÓ THỂ Xác định được 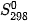 và và 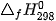 và suy ra xu hướng tự xảy ra của các phản ứng hoá học. và suy ra xu hướng tự xảy ra của các phản ứng hoá học. |
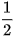 O2(g) → SO3(g)
O2(g) → SO3(g)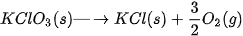
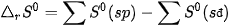
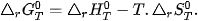
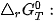
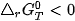 ⇒ Phản ứng tự xảy ra.
⇒ Phản ứng tự xảy ra.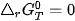 ⇒ Phản ứng đạt trạng thái cân bằng.
⇒ Phản ứng đạt trạng thái cân bằng.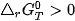 ⇒ Phản ứng không tự xảy ra.
⇒ Phản ứng không tự xảy ra.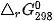





































































Bình Luận
Để Lại Bình Luận Của Bạn