(Trang 116)
MỤC TIÊU
- Nêu được trạng thái tự nhiên của nguyên tố nhóm IIA.
- Nêu các đại lượng vật lí cơ bản của kim loại nhóm IIA (bán kính nguyên tử, nhiệt độ nóng chảy, khối lượng riêng).
- Giải thích được nguyên nhân tính kim loại tăng dần từ trên xuống dưới trong cùng nhóm của kim loại nhóm IIA tạo M2+ (dựa vào bán kính nguyên tử, điện tích hạt nhân).
- Trình bày được phản ứng của kim loại nhóm IIA với oxygen.
- Nêu được mức độ tương tác của kim loại nhóm IIA với nước. Chứng minh được xu hướng tăng hoặc giảm dần mức độ các phản ứng dựa vào tính kiềm của dung dịch thu được cùng với độ tan của các hydroxide nhóm IIA.
- Nêu được khả năng tan trong nước của các muối carbonate, sulfate, nitrate nhóm IIA.
- Thực hiện được thí nghiệm so sánh định tính độ tan giữa calcium sulfate và barium sulfate từ phản ứng của calcium chloride, barium chloride với dung dịch copper(II) sulfate.
- Sử dụng được bảng tính tan, độ tan của muối và hydroxide.
- Nhận biết được các đơn chất và hợp chất của Ca2+, Sr2+, Ba2+ dựa vào màu ngọn lửa.
- Nêu được tương tác giữa muối carbonate với nước và với dung dịch acid loãng.
- Viết được phương trình hoá học sự phân huỷ nhiệt của muối carbonate và muối nitrate.
- Giải thích được quy luật biến đồi độ bền nhiệt của muối carbonate, muối nitrate theo biến thiên enthalpy phản ứng.
- Thực hiện được thí nghiệm kiểm tra sự có mặt từng ion riêng biệt Ca2+, Ba2+, SO2, CO-trong dung dịch.
- Tìm hiểu và trình bày được ứng dụng của kim loại dạng nguyên chất, hợp kim; ứng dụng của đá vôi, vôi, nước vôi, thạch cao, khoáng vật apatite,... dựa trên một số tính chất hoá học và vật lí của chúng; vai trò một số hợp chất của calcium trong cơ thể con người.
- Nêu được khái niệm nước cứng, phân loại nước cứng.
- Trình bày được tác hại của nước cứng.
- Đề xuất được cơ sở các phương pháp làm mềm nước cứng.
Trong nhóm IIA, magnesium và calcium là hai nguyên tố phổ biến nhất, đồng thời có vai trò quan trọng với sự sinh trường, phát triển của động vật và thực vật. Magnesium có trong chất diệp lục, calcium có trong vỏ và mai các loài giáp xác, trong xương và răng của người và động vật,... Ngoài ra, đơn chất và hợp chất nhóm IIA có nhiều ứng dụng phổ biến trong đời sống, sản xuất. Vậy, đơn chất nhóm IIA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất phổ biến của calcium có vai trò như thế nào với đời sống, sản xuất và cơ thể con người?

Mỏ lết
Vật liệu
Sản xuất
Pháo bông
Chất cản quang
Chất phóng xạ
Hình 25.1. Một số ứng dụng của nguyên tố nhóm IIA
(Trang 117)
I. ĐƠN CHẤT NHÓM IIA
1. Đặc điểm chung
Một số đại lượng đặc trưng của các nguyên tố nhóm IIA được trình bày trong Bảng 25.1.
Bảng 25.1. Một số đại lượng đặc trưng các nguyên tố nhóm IIA
| Nguyên tử | Số hiệu nguyên tử | Tên gọi | Cấu hình electron | Bán kính nguyên tử (pm) (1) | Thế điện cực chuẩn, V(2) |
| La | 4 | Beryllium | [He]2s2 | 112 | -1,99 |
| Mg | 12 | Magnesium | [Ne]3s2 | 160 | -2,356 |
| Ca | 20 | Calcium | [Ar]4s2 | 197 | -2,84 |
| Sr | 38 | Strontium | [Kr]5s2 | 215 | -2,89 |
| Ba | 56 | Barium | [Car]6s2 | 222 | -2,92 |
Thực hiện các yêu cầu sau:
1. Nhận xét xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA.
2. Dựa vào bán kính nguyên tử, điện tích hạt nhân, dự đoán xu hướng biến đổi tính khử từ Be đến Ba.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA. Giải thích.
Kim loại nhóm IIA là những nguyên tố s, đứng ngay sau nguyên tố kim loại kiềm ở mỗi chu kì.
Kim loại nhóm IIA có thể điện cực chuẩn EM2+/M nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử, thể hiện tính khử mạnh:
M2+ 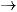 + 2e
+ 2e
Trong hợp chất, nguyên tử nhóm IIA thể hiện số oxi hoá đặc trưng là +2.
2. Trạng thái tự nhiên
Trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất. Magnesium và calcium là hai nguyên tố phổ biến trên vỏ Trái Đất, có trong nhiều khoáng vật như MgCO3  CaCO3 (dolomite), CaCO3 (calcite), Ca3(PO4)2 (phosphorite),...
CaCO3 (dolomite), CaCO3 (calcite), Ca3(PO4)2 (phosphorite),...
?
1. Tại sao trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất?
(1) Nguồn: Silberberg, M. S. 2007. Nguyên lý hóa học tổng quát, Giáo dục đại học McGraw-Hill.
(2) Nguồn: Dean, J. A. 1999. Sổ tay hóa học của Lange, Hoa Kỳ, McGraw-Hill, Inc.
(Trang 118)
3. Tính chất vật lí
Một số thông số vật lí của kim loại nhóm IIA được trình bày trong Bảng 25.2.
Bảng 25.2. Một số thông số vật lí của kim loại nhóm IIA(1)
| Kim loại | Nhiệt độ nóng chảy (°C) | Nhiệt độ sôi (°C) | Khối lượng riêng (g/cm³) |
| Be | 1 287 | 2 467 | 1,85 |
| Mg | 651 | 1 100 | 1,74 |
| Ca | 842 | 1 484 | 1,55 |
| Sr | 757 | 1 366 | 2,64 |
| Ba | 727 | 1 845 | 3,51 |
EM CÓ BIẾT
Cấu trúc tinh thể kim loại nhóm IIA
Beryllium và magnesium có cấu trúc lục phương chặt khít; calcium và strontium có cấu trúc lập phương tâm mặt; barium có cấu trúc lập phương tâm khối.
Kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn nhiệt độ nóng chảy của kim loại nhóm IA, nhưng tương đối thấp so với nhiệt độ nóng chảy của các kim loại khác.
Kim loại nhóm IIA đều là kim loại nhẹ, có khối lượng riêng tương đối nhỏ.
4. Tính chất hoá học
Kim loại nhóm IIA là các kim loại có tính khử mạnh, chỉ kém kim loại nhóm IA.
- Tác dụng với oxygen
Ở điều kiện thường, trong không khí beryllium bền do có lớp màng oxide bảo vệ, magesium bị oxi hoá chậm, các kim loại khác bị oxi hoá nhanh tạo thành oxide, bề mặt kim loại chuyển dần sang màu xám.
Khi đốt nóng trong không khí, beryllium phản ứng chậm với oxygen, các kim loại khác phản ứng mạnh với oxygen cho màu ngọn lửa đặc trưng (calcium cho màu đỏ cam, strontium cho màu đỏ son, barium cho màu lục).
(1) Nguồn: Dean, J. A. 1999. Sổ tay hóa học của Lange, Hoa Kỳ, McGraw-Hill, Inc.
(Trang 119)
- Tác dụng với nước
Bảng 25.3. Khả năng và mức độ tác dụng với nước của kim loại nhóm IIA
| Kim loại | Đặc điểm |
| Be | Không tác dụng với nước. |
| Mg | Phản ứng chậm với nước ở nhiệt độ thường, nhanh hơn khi đun nóng: Mg + 2H2O |
| Ca, Sr, Ba | Tác dụng mạnh với nước ở ngay nhiệt độ thường. Ví dụ: Ca + 2H2O→ Ca(OH)2 + H2
|
Độ tan trong nước của các hydroxide nhóm IIA ở 20 °C cho trong bảng sau:
| Hydroxide | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 |
| Độ tan (g/100 g nước) (1) | 1,25-10-3 | 0,173 | 1,77 | 3,89 |
Thực hiện các yêu cầu sau:
1. Nêu xu hướng biến đổi độ tan của các hydroxide nhóm IIA.
2. Dự đoán xu hướng phản ứng với nước của kim loại nhóm IIA (từ Mg đến Ba) dựa vào độ tan của các hydroxide.
Trong phản ứng của kim loại nhóm IIA với nước, sản phẩm tạo thành càng dễ tan thì càng dễ giải phóng khỏi bề mặt kim loại, tạo điều kiện để kim loại tiếp tục phản ứng với nước.
5. Ứng dụng
Các kim loại nhóm IIA và hợp kim của chúng có nhiều ứng dụng trong thực tế: Be dùng để chế tạo hợp kim có độ bền cơ học, không bị ăn mòn, khó nóng chảy,...; Mg dùng để chế tạo hợp kim làm vật liệu sản xuất ô tô, máy bay, chi tiết máy,...
II. HỢP CHẤT CỦA KIM LOẠI NHÓM IIA
1. Đặc điểm chung
Độ tan (g/100 g nước) của các muối sulfate, carbonate và nitrate của kim loại nhóm IIA ở 20 °C (1) cho trong bảng sau:
| Anion | Cation | |||
| Mg2+ | Ca2+ | Sr2+ | Ba2+ | |
| CO2- | 0,01 | 0,0013 | 0,0011(2) | 0,0024 |
| SO2-4 | 33,7 | 0,20 | 0,0132 | 0,0028 |
| NO3 | 69,5 | 152(3) | 69,5 | 9,02 |
(1) Nguồn: Dean, J. A. 1999. Lange's handbook of chemistry, United States of America, McGraw-Hill, Inc.
(2) Nguồn: National Center for Biotechnology Information (2024). PubChem Compound Summary for CID 15407, Strontium carbonate. Retrieved January 2, 2024 from https://pubchem.ncbi.nlm.nih.gov/compound/Strontium-carbonate.
(3) Solubility is determined at 30 °C.
(Trang 120)
Thực hiện yêu cầu sau:
Nhận xét về khả năng hoà tan (dễ tan/ít tan/không tan) của các muối của kim loại nhóm IIA.
EM CÓ BIẾT
Sự phân loại tính tan các chất dựa vào độ tan (g/100 gam nước) của chúng như sau:

Độ tan
Phân loại
Chất không tan
Chất ít tan
Chất dễ tan
Tính tan trong nước của một số hợp chất nhóm IIA được trình bày trong Bảng 25.4.
Bảng 25.4. Tính tan trong nước của một số hợp chất nhóm IIA
| Anion | Cation | |||
| Mg2+ | Ca2+ | Sr2+ | Ba2+ | |
| CO2-3 | K | K | K | K |
| SO2-4 | T | I | I | K |
| NO3- | T | T | T | T |
| OH- | K | T | T | T |
T: chất dễ tan; 1: chất ít tan; K: chất không tan
Thí nghiệm: So sánh độ tan giữa calcium sulfate và barium sulfate
Chuẩn bị:
Hoá chất: các dung dịch CaCl2 1 M, BaCl2 1 M, CuSO4 1 M.
Dụng cụ: ống nghiệm, giá ống nghiệm.
Tiến hành:
- Đặt 2 ống nghiệm vào giá. Thêm khoảng 2 mL dung dịch CaCl2 vào ống nghiệm (1), 2 mL dung dịch BaCl2 vào ống nghiệm (2).
- Nhỏ từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm cho đến khi xuất hiện kết tủa.
Quan sát hiện tượng xảy ra và thực hiện yêu cầu sau:
So sánh thời điểm xuất hiện kết tủa ở hai ống nghiệm và giải thích.
(Trang 121)
Tương tự kim loại nhóm IA, đốt nóng các kim loại nhóm IIA hoặc hợp chất của chúng trong ngọn lửa không màu làm ngọn lửa có màu đặc trưng: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục.
2. Đề xuất cách phân biệt ba dung dịch bão hoà: CaCl2, SrCl2, BaCl2.

Hình 25.2. Màu ngọn lửa ion kim loại nhóm IIA
2. Một số hợp chất quan trọng
a) Muối carbonate và nitrate
- Tác dụng với acid
Muối carbonate của kim loại nhóm IIA là muối của acid yếu, tác dụng được với nhiều acid vô cơ và hữu cơ, giải phóng khí carbon dioxide.
1. Viết phương trình hoá học của phản ứng giữa CaCO3 với dung dịch HCI, với dung dịch CH3COOH.
2. Đề xuất cách làm sạch cặn đá vôi trong phích nước.
Muối carbonate của kim loại nhóm IIA tan dần trong nước có hoà tan khí carbon dioxide. Ví dụ:
CaCO3 + CO2 + H2O  Ca(HCO3)2
Ca(HCO3)2
- Phản ứng nhiệt phân
Các muối carbonate của kim loại nhóm IIA đều bị phân huỷ bởi nhiệt:
t° MCO3(s) MO(S) + CO2(g) ← ΔΗ 298 Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau(1):
| Muối | MgCO3(S) | CaCO3(S) | SrCO3(s) | BaCO3(s) |
| A,Ho298 (KJ) | 100,7 | 179,2 | 234,6 | 271,5 |
Thực hiện các yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của các muối carbonate của kim loại nhóm IIA.
Tương tự muối carbonate, các muối nitrate của kim loại nhóm IIA cũng đều bị phân huỷ nhiệt tạo thành oxide.
(1) Nguồn: Dean, J. A. 1999. Sổ tay hóa học của Lange, Hoa Kỳ, McGraw-Hill, Inc.
(Trang 122)
Biến thiên enthalpy chuẩn của phản ứng nhiệt phân các muối nitrate của kim loại nhóm IIA:
M(NO3)2(S) 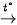 MO(S) + 2NO2(g) +
MO(S) + 2NO2(g) + 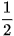 O2(g)
O2(g)
| Muối | MgCO3(S) | CaCO3(S) | SrCO3(s) | BaCO3(s) |
| A,Ho298 (KJ) | 255,2 | 369,5 | 452,4 | 506,2 |
Thực hiện yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của muối nitrate của kim loại nhóm IIA.
b) Nhận biết từng ion riêng rẽ Ca2+, Ba2+, SO2-4, CO2-3 trong dung dịch
Thí nghiệm: Phân biệt từng ion riêng rẽ Ca2+, Ba2+, SO, CO3 trong dung dịch
Chuẩn bị:
Hoá chất: các dung dịch: CaCl2 1 M, BaCl2 1 M, Na2SO4 1M, Na2CO3 1M, HCI 2 M.
Dụng cụ: ống nghiệm, giá ống nghiệm.
Tiến hành:
1. Nhận biết từng ion riêng rẽ Ca2+, Ba2+, SO
- Cho vào ống nghiệm (1) khoảng 1 mL dung dịch CaCl2 1 M, ống nghiệm (2) khoảng 1 mL dung dịch BaCl2 1 M, ống nghiệm (3) khoảng 1 mL Na2SO4 1 M.
- Nhỏ từ từ từng giọt dung dịch Na2SO4 1 M vào mỗi ống nghiệm (1) và ống nghiệm (2); nhỏ vài giọt dung dịch BaCl2 1 M vào ống nghiệm (3).
Chú ý: BaCl2 độc, cần tuân thủ quy tắc an toàn trong phòng thí nghiệm.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
2. Ở ống nghiệm (1) và (2), ống nào tạo kết tủa nhanh hơn? Nhiều hơn?
2. Nhận biết ion CO3
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl₂ 1 M, lắc đều.
- Thêm tiếp 2 mL dung dịch HCI 2 M vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Nêu các hiện tượng xảy ra và giải thích.
(1) Nguồn: Dean, J. A. 1999. Sổ tay hóa học của Lange, Hoa Kỳ, McGraw-Hill, Inc.
(Trang 123)
3. Ứng dụng
Các nguyên, vật liệu chứa calcium như đá vôi, või, nước vôi, thạch cao, quặng apatite, quặng fluorite,... có nhiều ứng dụng trong đời sống và sản xuất (Bảng 25.5).
Bảng 25.5 Một số ứng dụng của các nguyên, vật liệu chứa calcium
| Nguyên, vật liệu | Ứng dụng |
| Đá vôi | Sản xuất või sống, xi măng, vật liệu xây dựng.... |
| Vôi sống | Khử chua; sát trùng, tẩy uế; hút ẩm trong công nghiệp:.... |
| Vôi, nước vôi | Khử chua, làm mềm nước cứng..... |
| Thạch cao | Vật liệu xây dựng, phần viết bảng..... |
| Apatit | Sản xuất phân lân (superphosphate, nung chảy....)..... |
Một số hợp chất của calcium còn có vai trò quan trọng đối với cơ thể con người như: calcium phosphate, hydroxylapatite tham gia cấu tạo xương và răng.
? 3. Tìm hiểu và trình bày vai trò của calcium trong cơ thể con người mà em biết.
III. NƯỚC CỨNG
1. Khái niệm, phân loại
a) Khái niệm
Nước trong tự nhiên như nước mặt (nước sông, suối, ao, hồ,...) và nước ngầm thường hoà tan muối của nhiều ion kim loại như Ca2+, Mg2+,...
Nước chứa nhiều ion Ca2+ và Mg2+ được gọi là nước cứng. Nước chứa ít hoặc không chứa các ion Ca2+ và Mg2+ được gọi là nước mềm.
b) Phân loại
Căn cứ vào thành phần của anion gốc acid tạo muối với ion Ca2+ và Mg2+, nước cứng được phân làm ba loại: nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần.
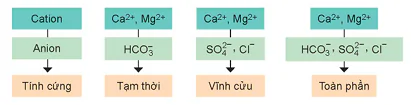
Hình 25.3. Phân loại tính cứng của nước
Nước tự nhiên thường có tính cứng toàn phần, tức là có cả tính cứng tạm thời và tính cứng vĩnh cửu.
(Trang 124)
4.
a) Khi đun nóng nước có tính cứng tạm thời, phần lớn các ion Ca2+ và Mg2+ được tách ra khỏi nước ở dạng kết tủa muối carbonate.
Viết phương trình hoá học của các phản ứng xảy ra.
b) Giải thích sự tạo thành cặn đá vôi trong phích nước, ấm đun nước.
2. Tác hại của nước cứng
Nước cứng ảnh hưởng nhiều đến các hoạt động trong sản xuất và đời sống.
Một số ví dụ về tác hại của nước cứng:
- Nồi hơi dễ bị đóng cặn gây tốn nhiên liệu và không an toàn.
- Đường ống dẫn nước dễ bị đóng cặn làm giảm lưu lượng nước hoặc tắc đường ống.
- Giặt bằng xà phòng sẽ tạo ra muối ít tan bám vào quần áo, xà phòng tạo ít bọt, tốn xà phòng, quần áo mau hỏng.
- Nấu ăn bằng nước cứng làm cho thực phẩm lâu chín, giảm mùi vị.
?
5. Trình bày về tác hại của nước cứng với sản xuất và đời sống.
3. Làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các cation Ca2+ và Mg2+ trong nước cứng. Có hai phương pháp làm mềm nước cứng phổ biến: chuyển các cation Ca2+ và Mg2+ vào hợp chất không tan (phương pháp kết tủa) và thay thế những cation này bằng các cation khác (phương pháp trao đổi ion).
a) Phương pháp kết tủa
1. Đề xuất hai cách (không dùng hoá chất và có dùng hoá chất) để làm mềm mẫu nước có tính cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2 . Viết phương trình hoá học để minh hoạ.
2. Đề xuất hai hoá chất có thể dùng để làm mềm mẫu nước có tính cứng vĩnh cửu chứa CaCl2 và MgSO4. Giải thích.
b) Phương pháp trao đổi ion
Vật liệu có khả năng trao đổi một số ion trong thành phần cấu tạo của chúng với các ion có trong dung dịch gọi là vật liệu trao đổi ion.
Các vật liệu trao đổi ion thường dùng trong xử lí nước cứng là các vật liệu polymer có khả năng trao đổi cation, thường gọi là nhựa cationite. Khi nước cứng chảy qua cột chứa nhựa trao đổi ion, các ion Ca2+, Mg2+ trong nước sẽ bị hấp thụ và ở lại trên cột, đồng thời các cation như Na+, H+ được giải phóng từ cột vào nước.
(Trang 125)
EM ĐÃ HỌC
- Các kim loại nhóm IIA có tính khử mạnh nên chúng chỉ tồn tại trong tự nhiên dưới dạng hợp chất.
- Kim loại nhóm IIA (từ Mg đến Ba) tác dụng với nước theo mức độ phản ứng tăng dần.
- Khi đốt nóng, các kim loại nhóm IIA và hợp chất của chúng có màu ngọn lửa đặc trưng: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục.
- Độ bền nhiệt của muối carbonate và nitrate của kim loại nhóm IIA có xu hướng tăng dần từ Be đến Ba.
- Các hợp chất của kim loại nhóm IIA có nhiều ứng dụng trong đời sống, sản xuất và có vai trò quan trọng đối với cơ thể người.
- Kiểm tra sự có mặt của ion Ca2+, Ba2+, SO4, CO3 trong dung dịch thông qua phản ứng trao đổi để tạo thành kết tủa CaSO4, BaSO4 và CaCO3.
- Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+. Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các cation Ca2+ và Mg2+ trong nước cứng.
EM CÓ THỂ
Hiểu được tác hại của nước cứng với sản xuất, có thể đề xuất được hoá chất phù hợp để làm mềm nước cứng.
 Mg(OH)2 + H2
Mg(OH)2 + H2




































































Bình Luận
Để Lại Bình Luận Của Bạn