Nội Dung Chính
(Trang 62)
Học xong bài học này, em có thể:
• Nêu được khái niệm về muối (các muối thông thường là hợp chất được hình thành từ sự thay thế ion H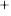
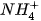 ).
). • Chỉ ra được một số muối tan và muối không tan từ bảng tính tan.
• Trình bày được một số phương pháp điều chế muối.
• Đọc được tên một số loại muối thông dụng.
• Tiến hành được thí nghiệm muối phản ứng với kim loại, với acid, với base, với muối; nêu và giải thích được hiện tượng xảy ra trong thí nghiệm (Viết phương trình hoá học) và rút ra kết luận về tính chất hoá học của muối.
• Trình bày được mối quan hệ giữa acid, base, oxide và muối; rút ra được kết luận về tính chất hoá học của acid, base, oxide.
![]() Muối là loại hợp chất có nhiều trong tự nhiên, trong nước biển, trong đất, trong các mỏ (hình 12.1). Vậy muối là gì? Muối có những tính chất hoá học nào? Mối liên hệ giữa muối với các loại hợp chất khác được thể hiện như thế nào?
Muối là loại hợp chất có nhiều trong tự nhiên, trong nước biển, trong đất, trong các mỏ (hình 12.1). Vậy muối là gì? Muối có những tính chất hoá học nào? Mối liên hệ giữa muối với các loại hợp chất khác được thể hiện như thế nào?
|
a) Muối ăn (NaCl) có nhiều trong nước biển |
b) |
Hình 12.1. Một số muối trong tự nhiên
I. KHÁI NIỆM MUỐI
Trong các bài học trước chúng ta đã biết khi dung dịch acid tác dụng với kim loại, base, oxide base sẽ tạo ra muối.
Ví dụ:
HCI + NaOH → NaCl + 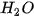
Sodium chloride
Trong phản ứng trên ion H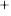 của hydrochloric acid đã được thay thế bởi ion Na
của hydrochloric acid đã được thay thế bởi ion Na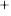 .
.
(Trang 62)
| Khi tác dụng với oxide base hoặc kim loại, ion H Ví dụ: 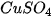 + + 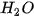 Copper(II) sulfate Muối ammonium được tạo ra khi thay thế ion H Ví dụ: 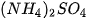 (ammonium sulfate). (ammonium sulfate). Muối là những hợp chất được tạo ra khi thay thế ion H | 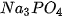 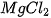 , , 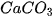 , , 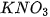 tương ứng với acid nào trong số các acid sau: HCl, tương ứng với acid nào trong số các acid sau: HCl, 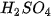 , , 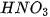 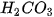 . . |
II. TÊN GỌI CỦA MUỐI
Tên gọi muối của một số acid được trình bày trong bảng 12.1 dưới đây.
Bảng 12.1. Tên gọi muối của một số acid
| Acid | Muối | Ví dụ |
| Hydrochloric acid (HCI) | Muối chloried | Sodium chloride: NaCl |
Sulfuric acid (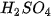 ) ) | Muối sulfate | Copper(II) sulfate: 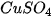 |
Phosphoric acid (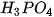 ) ) | Muối phosphate | Potassium phosphate: 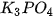 |
Carbonic acid (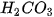 ) ) | Muối carbonate | Calcium carbonate: 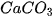 |
Nitric acid (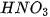 ) ) | Muối nitrate | Magnesium nitrate: 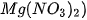 |
![]()
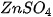 ,
, 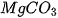 ,
, 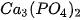 ,
, 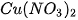 ,
, 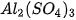
III. TÍNH TAN CỦA MUỐI
| • Có muối tan tốt trong nước như: NaCl, • Có muối ít tan trong nước như: • Có muối không tan trong nước như: 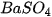 , AgCl,... , AgCl,... Tính tan của một số muối được trình bày trong bảng tính tan của các chất (xem Phụ lục). | 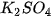 , , 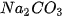 , , 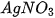 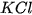 , , 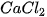 , , 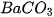 , , 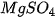 . . |
(Trang 64)
IV. TÍNH CHẤT HOÁ HỌC CỦA MUỐI
1. Tác dụng với kim loại
Tiến hành thí nghiệm sau để tìm hiểu tác dụng của muối với kim loại.
|
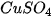 có màu xanh lam, dung dịch có màu xanh lam, dung dịch 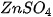 không màu. Viết phương trình hoá học xảy ra khi ngâm Zn trong dung dich không màu. Viết phương trình hoá học xảy ra khi ngâm Zn trong dung dich 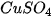 dự đoán sự thay đổi về màu của dung dịch trong quá trình trên. dự đoán sự thay đổi về màu của dung dịch trong quá trình trên. 4. Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau: a) Cho Fe vào dung dịch b) Cho Zn vào dung dịch |
Chuẩn bị • Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt, miếng bìa màu trắng. • Hoá chất: Mẫu dây đồng, dung dịch Tiến hành • Cho mẫu dây đồng (dài khoảng 2 cm) vào ống nghiệm, thêm vào ống nghiệm khoảng 2 mL dung dịch • Mô tả các hiện tượng xảy ra. • Bề mặt sợi dây đồng và màu dung dịch trong ống nghiệm thay đổi như thế nào? Giải thích. |
Kết quả thí nghiệm trên cho thấy có phản ứng hoá học giữa dung dịch 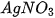 và Cu.
và Cu.
Phương trình hoá học như sau:
2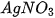
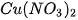 + 2Ag↓
+ 2Ag↓ Silver nitrate Copper(II) nitrate
Phản ứng cũng xảy ra tương tự khi cho Mg, Zn,... vào các dung dịch 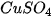 ,
, 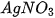 ,...
,...
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
2. Tác dụng với acid
Tiến hành thí nghiệm sau để tìm hiểu tác dụng của muối với dung dịch acid.
![]() Thí nghiệm 2
Thí nghiệm 2
Chuẩn bị
• Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
• Hoá chất: Dung dịch 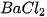
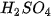 loãng .
loãng . Tiến hành
• Lấy khoảng 2 mL dung dịch 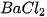 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt dung dịch
cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt dung dịch 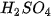 vào ống nghiệm (khoảng 5 giọt).
vào ống nghiệm (khoảng 5 giọt).
• Mô tả các hiện tượng xảy ra. Giải thích.
(Trang 65)
| Dung dịch 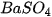 không tan, màu trắng theo phương trình hoá học sau: không tan, màu trắng theo phương trình hoá học sau: Barium chloride Barium sulfate Nhiều muối khác cũng tác dụng được với dung dịch acid tạo thành muối mới và acid mới. 3. Tác dụng với baseTiến hành thí nghiệm sau để tìm hiểu phản ứng giữa dung dịch muối và dung dịch base. |
a) Nhỏ dung dịch b) Nhỏ dung dịch HCl loãng vào dung dịch Giải thích và viết phương trình hoá học xảy ra (nếu có).
|
![]() Thí nghiệm 3
Thí nghiệm 3
Chuẩn bị
• Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
• Hoá chất: Dung dịch 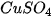
Tiến hành
• Lấy khoảng 2 mL dung dịch 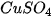 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt dung dịch NaOH vào ống nghiệm.
cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt dung dịch NaOH vào ống nghiệm.
• Mô tả các hiện tượng xảy ra. Giải thích.
Dung dịch 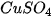 phản ứng với dung dịch NaOH tạo ra chất không tan
phản ứng với dung dịch NaOH tạo ra chất không tan 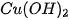 theo phương trình hoá học sau:
theo phương trình hoá học sau:
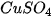 + 2NaOH →
+ 2NaOH → 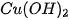
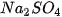
CuSO4 + 2NaOH→ Cu(OH)2+ Na2SO, Sodium sulfate Copper(II) sulfate
4
6. Viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Dung dịch FeCl, tác dụng với dung dịch NaOH.
b) Dung dich CuCl the dung


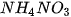
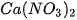 ,...
,...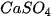 ,
, 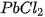 ,...
,...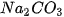 .
.




















Bình Luận
Để Lại Bình Luận Của Bạn