Nội Dung Chính
(Trang 36)
Học xong bài học này, em có thể:
• Nêu được dung dịch là hỗn hợp lỏng đồng nhất của các chất đã tan trong nhau.
• Nêu được định nghĩa độ tan của một chất trong nước, nồng độ phần trăm, nồng độ mol.
• Tính được độ tan, nồng độ phần trăm; nồng độ mol theo công thức.
• Tiến hành được thí nghiệm pha một dung dịch theo một nồng độ cho trước.

|
2. Tính khối lượng sodium chloride cần hoà tan trong 200 gam nước ở 20°C để thu được dung dịch muối ăn bão hoà.
| I. ĐỘ TAN CỦA MỘT CHẤT TRONG NƯỚCKhi cho một thìa muối ăn vào cốc nước và khuấy đều, ta được dung dịch muối ăn, trong đó các hạt muối ăn bị tan ra và phân bổ đều trong nước tạo thành hỗn hợp đồng nhất. Trong quá trình này, muối ăn là chất tan, nước là dung môi và nước muối là dung dịch. Dung dịch là hỗn hợp lỏng đồng nhất của chất tan và dung môi. 1. Định nghĩaCho dần muối ăn vào cốc chứa 200 mL nước, khuấy đều cho đến khi muối ăn không thể hoà tan thêm được nữa, tách bỏ chất rắn không tan, ta thu được dung dịch bão hoà. Lượng muối ăn hoà tan tối đa trong 100 gam nước tạo thành dung dịch bão hoà ở 20 °C là 35,9 gam. Người ta nói độ tan của muối ăn là 35,9 gam trong 100 gam nước ở 20 °C. Độ tan (kí hiệu là S) của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định. Các chất khác nhau có độ tan khác nhau. Ví dụ: Độ tan của NaCl trong nước ở 25 °C là 36 g/100 g |
(Trang 37)
2. Cách tính độ tan của một chất trong nướcVí dụ Tính độ tan của muối potassium chloride (KCl) ở 20 °C, biết 50 gam nước hoà tan tối đa 17 gam muối.
Công thức tính độ tan của một chất ở nhiệt độ xác định là:
Trong đó:
3. Ảnh hưởng của nhiệt độ đến độ tan của chất rắn trong nước• Khi tăng nhiệt độ, độ tan của hầu hết các chất rắn đều tăng. Ví dụ: Độ tan của đường ăn trong nước ở 30 °C là 216,7 gam trong khi ở 60 °C là 288,8 gam. • Có một số chất khi tăng nhiệt độ, độ tan lại giảm. II. NỒNG ĐỘ DUNG DỊCHĐể biểu thị lượng chất tan có trong một lượng dung môi hoặc lượng dung dịch cụ thể người ta dùng khái niệm nồng độ dung dịch. Có hai loại nồng độ dung dịch thường được sử dụng là nồng độ phần trăm và nồng độ mol. |
b) Có thể hoà tan tối đa bao nhiêu gam đường ăn trong 250 gam nước ở 60 °C? |
(Trang 38)
1. Nồng độ phần trăm
Nồng độ phần trăm (kí hiệu là C%) của một dung dịch là số gam chất tan có trong 100 gam dung dịch.
Công thức tính nồng độ phần trăm của dung dịch là:
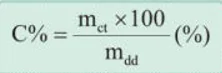
Trong đó:
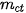 là khối lượng chất tan, có đơn vị là gam.
là khối lượng chất tan, có đơn vị là gam.
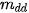 là khối lượng dung dịch, có đơn vị là gam.
là khối lượng dung dịch, có đơn vị là gam.
Khối lượng dung dịch bằng tổng khối lượng chất tan và khối lượng dung môi.
|
2. Từ muối ăn, nước và những dụng cụ cần thiết, nêu cách pha 500 gam dung dịch nước muối 0,9 %.
| Ví dụ 1 Hoà tan 20 gam đường ăn trong 60 gam nước thu được dung dịch đường. Tính C% của dung dịch đường đó. Khối lượng dung dịch đường là:
Nồng độ phần trăm của dung dịch là: C% = Nếu biết được nồng độ phần trăm của dung dịch thì ta có thể xác định được khối lượng chất tan và khối lượng dung dịch theo các biểu thức sau:
Ví dụ 2 Muốn pha 300 gam dung dịch muối
|
(Trang 39)
![]() Pha chế 100 gam dung dịch đường ăn (saccharose) 15%
Pha chế 100 gam dung dịch đường ăn (saccharose) 15%
Chuẩn bị
• Dụng cụ: Cân điện tử, cốc thuỷ tinh (loại 250 mL), đũa thuỷ tinh.
• Hoá chất: Đường ăn, nước cất.
Tiến hành
Bước 1: Cân chính xác 15 gam đường ăn cho vào cốc dung tích 250 mL.
Bước 2: Cân lấy 85 gam nước cất, rồi cho dần vào cốc và khuấy nhẹ cho tới khi đường tan hết, thu được 100 gam dung dịch đường nồng độ 15%.
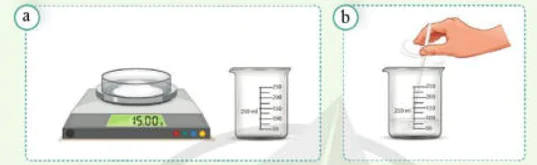
Hình 6.2. Thí nghiệm pha chế dung dịch đường ăn 15%
2. Nồng độ mol của dung dịch
Nồng độ mol (kí hiệu là 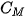 ) của một dung dịch là số mol chất tan có trong 1 lít dung dịch. Đơn vị của nồng độ mol là mol/L và thường được kí hiệu là M.
) của một dung dịch là số mol chất tan có trong 1 lít dung dịch. Đơn vị của nồng độ mol là mol/L và thường được kí hiệu là M.
| Công thức tính nồng độ mol của dung dịch: Trong đó: n là số mol chất tan, có đơn vị là mol. V là thể tích dung dịch, có đơn vị là lít. Ví dụ 3 Hoà tan hoàn toàn 42 gam sodium hydrogencarbonate ( Số mol của
Nồng độ mol của dung dịch Nếu biết được nồng độ mol của dung dịch ta có thể xác định được số mol chất tan và thể tích dung dịch theo các biểu thức sau :
|
Em có biết Có nhiều cách khác nhau để biểu thị nồng độ dung dịch. Để thuận tiện cho việc nghiên cứu, ngoài việc sử dụng nồng độ phần trăm và nồng độ mol, các nhà khoa học còn sử dụng thêm các loại nồng độ khác như nồng độ đương lượng và nồng độ molan. |
(Trang 40)
Pha chế dung dịch sodium bicarbonate 0,2 M
Sodium bicarbonate (hay còn gọi là sodium hydrogencarbonate,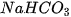 ) là thành phần chính của thuốc muối được sử dụng nhiều trong chế biến thực phẩm, y tế, vệ sinh vật dụng trong gia đình,... Để pha chế 100 mL dung dịch sodium bicarbonate 0,2 M có thể thực hiện theo thí nghiệm sau:
) là thành phần chính của thuốc muối được sử dụng nhiều trong chế biến thực phẩm, y tế, vệ sinh vật dụng trong gia đình,... Để pha chế 100 mL dung dịch sodium bicarbonate 0,2 M có thể thực hiện theo thí nghiệm sau:
Chuẩn bị
• Dụng cụ: Cân điện tử, phễu thuỷ tinh, ống đong, bình tam giác (loại 250 mL).
• Hoá chất: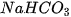
Tiến hành
Bước 1: Cân chính xác 1,68 gam muối 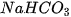 cho vào bình tam giác.
cho vào bình tam giác.
Bước 2: Thêm 100 mL nước cất vào bình tam giác, khuấy đều cho muối tan hết, thu được dung dịch 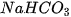 0,2 M
0,2 M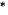 .
.
Hình 6.3. Thí nghiệm pha chế dung dịch sodium bicarbonate 0,2 M
Tìm hiểu thêm
Glucose được tạo ra từ các quá trình chuyển hoá thực phẩm và là một trong các nguồn cung cấp năng lượng chính cho cơ thể chúng ta. Với người bình thường, nồng độ glucose trong máu luôn được duy trì ổn định. Em hãy tìm hiểu và cho biết chỉ số nồng độ glucose trong máu của người bình thường nằm trong khoảng nào. Nếu chỉ số nồng độ glucose trong máu của một người lớn hơn mức bình thường thì người đó có nguy cơ mắc bệnh gì?
![]()
• Độ tan (kí hiệu là S) của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định.
• Nồng độ phần trăm (kí hiệu là C%) của một dung dịch là số gam chất tan có trong 100 gam dung dịch.
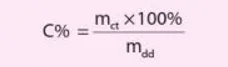
• Nồng độ mol (kí hiệu là 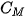 ) của một dung dịch là số mol chất tan có trong 1 lít dung dịch.
) của một dung dịch là số mol chất tan có trong 1 lít dung dịch.
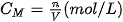
---------------------------------------------
(*) Một cách gần đúng, có thể coi thể tích dung dịch muối 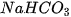 là 100 mL.
là 100 mL.
 .
.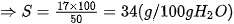 .
.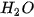 .
.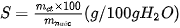
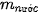 là khối lượng của nước, có đơn vị là gam.
là khối lượng của nước, có đơn vị là gam.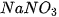 ) ở 0 °C, biết để tạo ra dung dịch
) ở 0 °C, biết để tạo ra dung dịch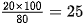 (%)
(%)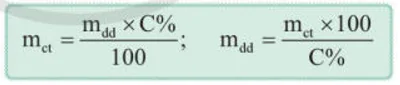
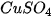 10% cần dùng bao nhiêu gam muối và bao nhiêu gam nước?
10% cần dùng bao nhiêu gam muối và bao nhiêu gam nước?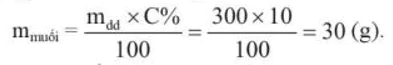
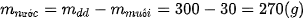 .
.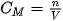
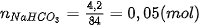
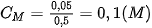
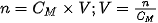
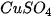 0,1 M.
0,1 M.

























Bình Luận
Để Lại Bình Luận Của Bạn