Nội Dung Chính
Biết sự điện li, chất điện li là gì.
Biết thế nào là chất điện li mạnh, chất điện li yếu.
I. HIỆN TƯỢNG ĐIỆN LÍ
1. Thí nghiệm
Chuẩn bị ba cốc : cốc (a) đựng nước cất, cốc (b) đựng dung dịch saccarozơ (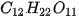
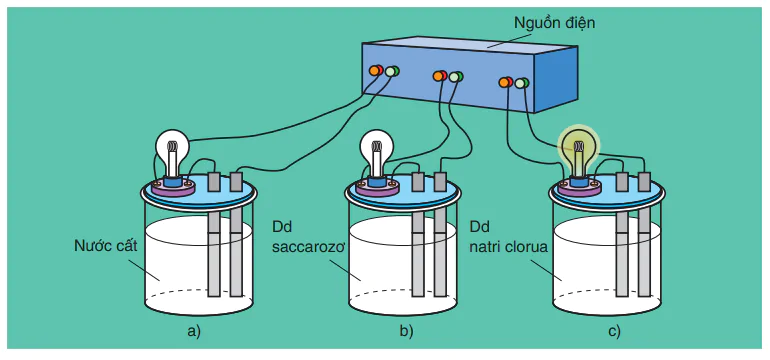
Hình 1.1. Bộ dụng cụ chứng mình tính dân điện của dung dịch
Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch NaCl bật sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
Nếu làm các thí nghiệm tương tự, người ta thấy : NaCl rắn, khan ; NaOH rắn, khan ; các dung dịch ancol etylic 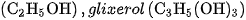 không dẫn điện. Ngược lại, các dung dịch axit, bazơ và muối đều dẫn điện.
không dẫn điện. Ngược lại, các dung dịch axit, bazơ và muối đều dẫn điện.
2. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Ngay từ năm 1887, A-rê-ni-ut đã giả thiết và sau này thực nghiệm đã xác nhận rằng : Tính dẫn điện của các dung dịch axit, bazơ và muối là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là
các ion.
Như vậy các axit, bazơ và muối khi hoà tan trong nước phân li ra các lon, nên dung địch của chúng dân điện.
Quá trình phân l¡ các chất trong nước ra Ion là sự điện lI. Những chất tan trong nước phân li ra ion được gọi là những chất điện li, Vậy axit, bazơ và muối là những chất điện l1.
Sự điện li được biểu diễn bằng phương trình điện li.
Thí dụ: 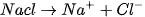
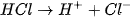
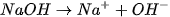
II. PHÂN LOẠI CÁC CHẤT ĐIỆN LI
1. Thí nghiệm
Chuẩn bị hai cốc : một cốc đựng dung dịch HCI 0,I0M, cốc kia đựng dung dịch 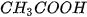 0,10M và lắp vào bộ dụng cụ như hình 1.1. Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta thấy bóng đèn ở cốc đựng dung dịch HCI sáng
0,10M và lắp vào bộ dụng cụ như hình 1.1. Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta thấy bóng đèn ở cốc đựng dung dịch HCI sáng
hơn so với bóng đèn ở cốc đựng dung dịch 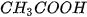 .
.
Điều đó chứng tỏ rằng : nồng độ ion trong dung dịch HCI lớn hơn nồng độ ion trong dung dịch 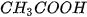 , nghĩa là số phân tử HCI phân li ra ion nhiều hơn so với số phân tử
, nghĩa là số phân tử HCI phân li ra ion nhiều hơn so với số phân tử 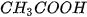 phân li ra ion.
phân li ra ion.
Dựa vào mức độ phân lI ra Ion của các chất điện l¡ khác nhau, người ta chia các chất điện l¡ thành chất điện lï mạnh và chất điện l¡ yếu.
2. Chất điện li mạnh và chất điện li yếu
a. Chất điện li mạnh
Chất điện li mạnh là chất khi tan trong nước (2), các phân tử hoà tan đều phân li ra ion.
(1) Nhiều chất khi nóng chảy cũng phân li ra ion, nên ở trạng thái nóng chảy các chất này dẫn điện được.
(2) Tất cả các chất đều ít nhiều tan trong nước. Thí dụ, ở 
 là
là 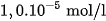 , của AgCl là
, của AgCl là 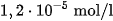 , của
, của 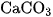 là
là 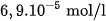
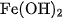 là
là 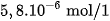 .
.
Thí dụ, NaCl là chất điện li mạnh. Nếu trong dung dịch có 100 phân tử NaCl hoà tan, thì cả 100 phân tử đều phân li ra ion.
Những chất điện li mạnh là các axit mạnh như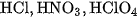 ,
,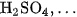 ; các bazơ mạnh như
; các bazơ mạnh như 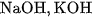
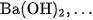 và hầu hết các muối.
và hầu hết các muối.
Trong phương trình điện li của chất điện li mạnh, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
Thí dụ :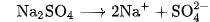
Vì sự điện li của 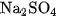 là hoàn toàn, nên ta dễ dàng tính được nồng độ các ion do
là hoàn toàn, nên ta dễ dàng tính được nồng độ các ion do 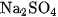 phân li ra.
phân li ra.
Thí dụ, trong dung dịch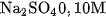
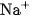 là 0,20
là 0,20 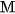 và nồng độ ion
và nồng độ ion 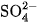 là
là 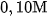 .
.
b) Chất điện li yếu
Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Thí dụ, trong dung dịch 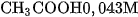
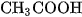 là chất điện li yếu.
là chất điện li yếu.
Nhưng chất điện li yếu là các axit yếu như 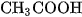 ,
, 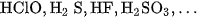 ; các bazơ yếu như
; các bazơ yếu như 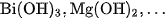
Trong phương trình điện li của chất điện li yếu, người ta dùng hai mũi tên ngược chiều nhau.
Thí dụ : 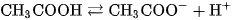
Sự phân li của chất điện li yếu là quá trình thuận nghịch, khi nào tốc độ phân li và tốc độ kết hợp các ion tạo lại phân tử bằng nhau, cân bằng của quá trình điện li được thiết lập. Cân bằng điện li là cân bằng động. Giống như mọi cân bằng hoá học khác, cân bằng điện li cũng tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.
BÀI TẬP
1. Các dung dịch axit như HCl , bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì ?
2. Sự điện li, chất điện li là gì ?
Những loại chất nào là chất điện li ? Thế nào là chất điện li mạnh, chất điện li yếu ? Lấy thí dụ và viết phương trình điện li của chúng.
3. Viết phương trình điện li của những chất sau :
a) Các chất điện li mạnh : 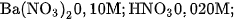
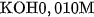 . Tính nồng độ mol của từng ion trong các dung dịch trên.
. Tính nồng độ mol của từng ion trong các dung dịch trên.
b) Các chất điện li yếu : 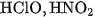 .
.
4. Chọn câu trả lời đúng trong các câu sau đây :
Dung dịch chất điện li dẫn điện được là do
A. sự chuyển dịch của các electron.
B. sự chuyển dịch của các cation.
C. sự chuyển dịch của các phân tử hoà tan.
D. sự chuyển dịch của cả cation và anion.
5. Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. 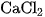 nóng chảy.
nóng chảy.
C. NaOH nóng chảy.
D. HBr hoà tan trong nước.














































Bình Luận
Để Lại Bình Luận Của Bạn