Nội Dung Chính
Biết thế nào là axit, bazo, hiđroxit lưỡng tính, muối theo thuyết A-rê-ni-ut và viết được phương trình điện li của chúng.
I - AXIT
1. Định nghĩa
Theo thuyết A-rê-ni-ut, axit là chất khi tan trong nước phân li ra cation 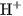
Thí dụ:
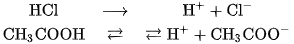
Các dung dịch axit đều có một số tính chất chung, đó là tính chất của các cation 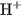 trong dung dịch.
trong dung dịch.
2. Axit nhiều nấc
Từ hai thí dụ trên ta thấy, phân tử HCl cũng như phân tử 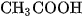 trong dung dịch nước chỉ phân li một nấc ra ion
trong dung dịch nước chỉ phân li một nấc ra ion 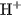 . Đó là các axit một nấc.
. Đó là các axit một nấc.
Những axit khi tan trong nước mà phân tử phân li nhiều nấc ra ion \mathrm{H}^{+}là các axit nhiều nấc.
Thí dụ: 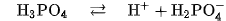
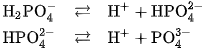
Phân tử 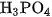 phân li ba nấc ra ion
phân li ba nấc ra ion 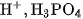 là axit ba nấc.
là axit ba nấc.
II - BAZƠ
Theo thuyết A-rê-ni-ut, bazơ là chất khi tan trong nước phân li ra anion 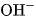 .
.
Thí du: 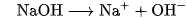
Các dung dịch bazơ đều có một số tính chất chung, đó là tính chất của các anion 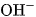 trong dung dịch.
trong dung dịch.
III - HIDROXIT LƯỠNG TÍNH
Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Thí dụ 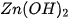 là hidroxit lưỡng tính :
là hidroxit lưỡng tính :
Sự phân li theo kiểu bazơ: 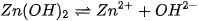
Sự phân li theo kiểu axit: 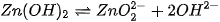
Để thể hiện tính axit của Zn(OH)›, người ta thường viết nó dưới dạng 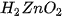
Các hiđroxit lưỡng tính thường gặp là 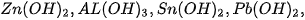 .
.
Chúng đều ít tan trong nước và lực axit (khả năng phân l¡ ra lon), lực bazơ đều yếu.
IV - MUỐI
1. Định nghĩa
Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc cation 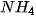 ) và anion gốc axit.
) và anion gốc axit.
Thí dụ:
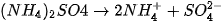
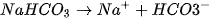
Muối mà anion gốc axit không còn hiđro có khả năng phân li ra Ion 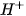
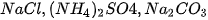 .
.
Nếu anion gốc axIt của muối vẫn còn hiđro có khả năng phân lï ra Ion Hr thì
muối đó được gọi là muối axit. Thí dụ : 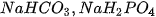
(1) Thực tế, trong dung dịch tồn tại ion 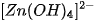 :
: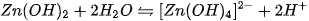
(2) Trong gốc axit của một số muối như Na;HPO:, NaH;PO; vẫn còn hiđro, nhưng là muối trung hoà, vì các hiđro đó không có tính axI.
2. Sự điện li của muối trong nước
Hầu hết các muối khi tan trong nước phân lí hoàn toàn ra cation kim loại (hoặc cation 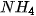
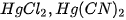 ....
....
là các chất điện l¡ yếu).
Thí dụ : 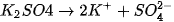
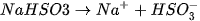
Nếu anion gốc axit còn hiđro có tính axit, thì gốc này tiếp tục phân li yếu ra 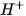 .
.
Thí dụ : 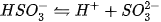
BÀI TẬP
Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính,
muối trung hoà, muối axit. Lấy các thí dụ minh hoạ và viết phương trình điện li của chúng.
Viết phương trình điện li của các chất sau :
a) các axit yếu : 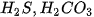
b) bazơ mạnh : LiOH.
c) các muối : 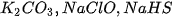 .
.
d) hiđroxit lưỡng tính : 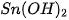 .
.
Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng ?
A. Một hợp chất trong thành phần phân tử có hiđro là axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
C. Một hợp chất có khả năng phân li ra cation H” trong nước là axit.
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
Đối với dung dịch axit yếu CH;COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh
giá nào về nồng độ mol ion sau đây là đúng ?
A. [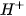 ]= 0,10M
]= 0,10M
B. [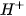
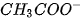 ]
]
C. [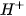 ] > [
] > [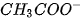 ]
]
D. [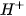 ] < 0,10M
] < 0,10M
Đối với dung dịch axit mạnh 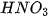
A. [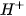 ]= 0,10M
]= 0,10M
B. [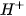 ] < [
] < [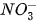 ]
]
C. [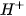 ]> [
]> [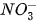
D. [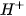 ]< 0,10M
]< 0,10M















































Bình Luận
Để Lại Bình Luận Của Bạn