Nội Dung Chính
- Biết các tính chất vật lí, hoá học của amoniac và muối amoni.
- Biết vai trò quan trọng của amoniac và muối amoni trong đời sống và trong sản xuất.
A - AMONIAC
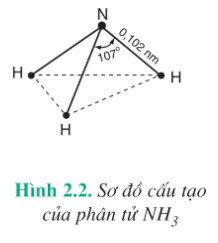
I - CẤU TẠO PHÂN TỬ
Trong phân tử amoniac, nguyên tử N liên kết với ba nguyên tử hiđro bằng ba liên kết cộng hoá trị có cực. Những đôi electron dùng chung lệch về phía nguyên tử nitơ có độ âm điện lớn hơn. Phân tử 
Trong phân tử  , nguyên tử N còn có một cặp electron hoá trị có thể tham gia liên kết với nguyên tử khác.
, nguyên tử N còn có một cặp electron hoá trị có thể tham gia liên kết với nguyên tử khác.
II - TÍNH CHẤT VẬT LÍ
Amoniac là chất khí không màu, có mùi khai và xốc, nhẹ hơn không khí. Khí amoniac tan rất nhiều trong nước : Ổ điều kiện thường, 1 lít nước hoà tan được khoảng 800 lít khí amoniac.
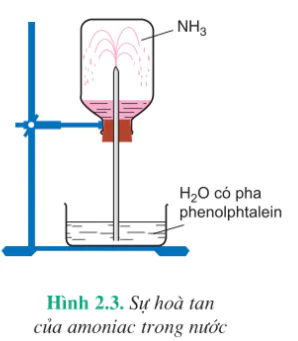
Thí nghiệm :
Nạp đầy khí amoniac vào bình thuỷ tinh trong suốt, đậy bình bằng nút cao su có ống thuỷ tinh vuốt nhọn xuyên qua. Nhúng đầu ống thuỷ tinh vào một chậu thuỷ tinh chứa nước có pha thêm dung dịch phenolphtalein. Một lát sau, nước trong chậu phun vào bình thành những tia có màu hồng (hình 2.3). Đó là vì khí amoniac tan nhiều trong nước làm giảm áp suất trong bình và nước bị hút vào bình. Phenolphtalein chuyển thành màu hồng, chứng tỏ dung dịch có tính bazơ.
Dung dịch thu được gọi là dung dịch amoniac. Dung dịch amoniac đậm đặc thường dùng trong phòng thí nghiệm có nồng độ 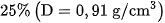 .
.
III - TÍNH CHẤT HOÁ HỌC
1. Tính bazo yếu
a) Tác dụng với nước
Khi tan trong nước, 
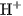 của nước, tạo thành ion amoni
của nước, tạo thành ion amoni 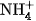 và ion hiđroxit
và ion hiđroxit 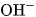 , làm cho dung dịch có tính bazơ và dẫn điện :
, làm cho dung dịch có tính bazơ và dẫn điện : 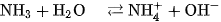
Trong dung dịch, amoniac là bazơ yếu. Có thể dùng giấy quỳ tím ẩm để nhận biết khí amoniac, quỳ tím sẽ chuyển thành màu xanh.
b) Tác dụng với dung dịch muối
Dung dịch amoniac có thể tác dụng với dung dịch muối của nhiều kim loại, tạo thành kết tủa hiđroxit của các kim loại đó.
Thí dụ :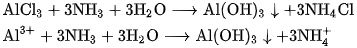
'c) Tác dụng với axit
Khí amoniac, cũng như dung dịch amoniac, tác dụng với dung dịch axit tạo ra muối amoni.
Thí dụ :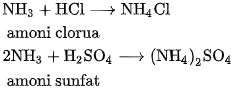
2. Tính khử
Trong phân tử amoniac, nitơ có số oxi hoá -3 , là số oxi hoá thấp nhất, vì vậy amoniac có tính khử. Tính chất này được thể hiện khi amoniac tác dụng với các chất oxi hoá.
a) Tác dụng với oxi
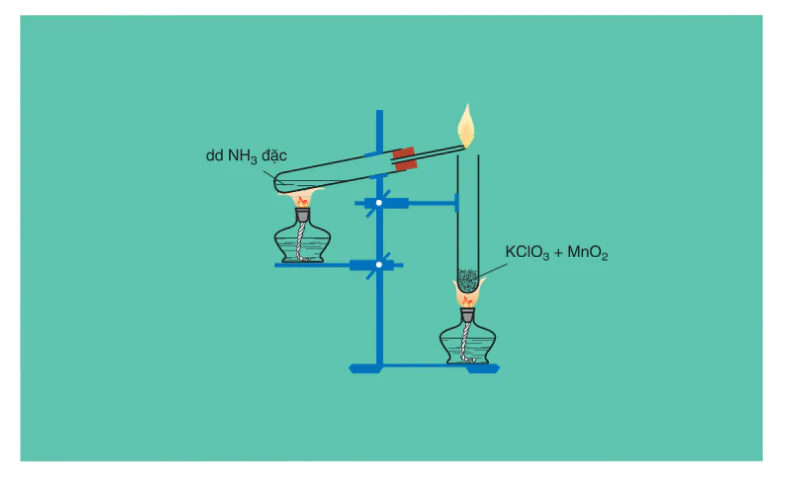
Amoniac cháy trong oxi cho ngọn lửa màu vàng, tạo ra khí nitơ và hơi nước (hình 2.4) :
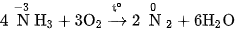
b) Tác dụng với clo
Clo oxi hoá mạnh amoniac tạo ra nitơ và hiđro clorua :

Đồng thời 
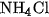 .
. IV - ỨNG DỤNG
Amoniac được sử dụng chủ yếu để sản xuất axit nitric, phân đạm như urê, amoni nitrat, amoni sunfat, ... ; điều chế hiđrazin 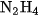 làm nhiên liệu cho tên lửa. Amoniac lỏng được dùng làm chất gây lạnh trong thiết bị lạnh.
làm nhiên liệu cho tên lửa. Amoniac lỏng được dùng làm chất gây lạnh trong thiết bị lạnh.
V - ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Khí amoniac được điều chế bằng cách đun nóng muối amoni, thí dụ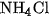 , với
, với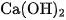 (hình 2.5).
(hình 2.5).
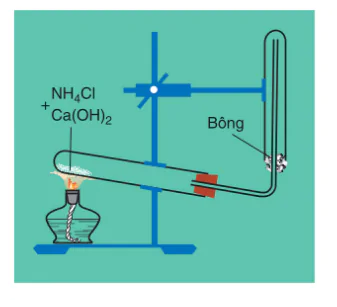
Hình 2.5.
Điều chế khí amoniac trong phòng thí nghiệm
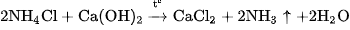
Để làm khô khí, người ta cho khí amoniac vừa tạo thành có lẫn hơi nước đi qua bình đựng vôi sống 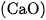 .
.
Khi muốn điều chế nhanh một lượng nhỏ khí amoniac, người ta thường đun nóng dung dịch amoniac đậm đặc.
2. Trong công nghiệp
Khí amoniac được tổng hợp từ nitơ và hiđro theo phản ứng :
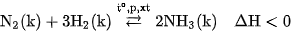
Đây là phản ứng thuận nghịch và toả nhiệt. Các điều kiện áp dụng trong công nghiệp sản xuất amoniac là :
- Nhiệt độ : 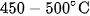 . Ở nhiệt độ thấp hơn, cân bằng hoá học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng.
. Ở nhiệt độ thấp hơn, cân bằng hoá học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng.
- Áp suất cao, từ 200 đến 300 atm .
- Chất xúc tác là sắt kim loại được trộn thêm 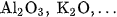
Trong khí amoniac tạo thành còn lẫn nitơ và hiđro. Hỗn hợp khí được làm lạnh, chỉ có amoniac hoá lỏng và tách ra. Còn nitơ và hiđro chưa tham gia phản ứng lại được bổ sung vào hỗn hợp nguyên liệu ban đầu.
B - MUỐI AMONI
Muối amoni là chất tinh thể ion, gồm cation amoni 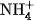 và anion gốc axit.
và anion gốc axit.
Thí du ̣: 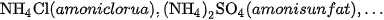
I - TíNH CHẤT VẬT Lí
Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn thành các ion. Ion 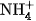 không có màu.
không có màu.
II - TÍNH CHẤT HOÁ HỌC
1. Tác dụng với dung dịch kiềm
Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sẽ cho khí amoniac bay ra.
Thí dụ:
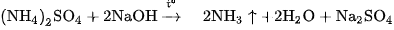
Phương trình ion rút gọn :
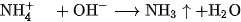
Dựa vào tính chất này người ta có thể nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm.
2. Phản ứng nhiệt phân
Các muối amoni dễ bị phân huỷ bởi nhiệt.
- Muối amoni chứa gốc axit không có tính oxi hoá khi đun nóng bị phân huỷ thành amoniac.
Thí d u ̣ :
Tinh thể 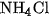 khi được đun nóng trong ống nghiệm (hình 2.6) sẽ phân huỷ thành khí
khi được đun nóng trong ống nghiệm (hình 2.6) sẽ phân huỷ thành khí  và khí HCl
và khí HCl 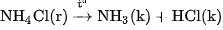
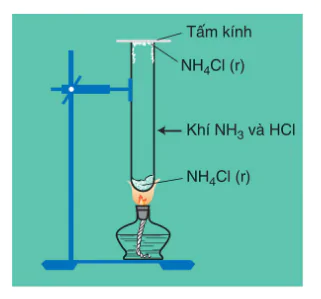
Hình 2.6. Sư phân huỷ của 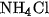
Khi bay lên miệng ống gặp nhiệt độ thấp hơn, hai khí này lại hoá hợp với nhau tạo lại tinh thể 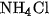 màu trắng.
màu trắng.
Các muối amoni cacbonat và amoni hiđrocacbonat bị phân huỷ dần dần ngay ở nhiệt độ thường giải phóng khí  và khí
và khí 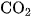 , khi đun nóng phản ứng xảy ra nhanh hơn :
, khi đun nóng phản ứng xảy ra nhanh hơn :
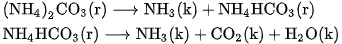
Trong thực tế, người ta thường dùng muối 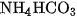
- Muối amoni chứa gốc của axit có tính oxi hoá như axit nitrơ, axit nitric khi bị nhiệt phân cho ra
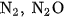 (đinitơ oxit).
(đinitơ oxit). Thí du ̣ :
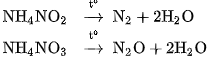
Những phản ứng này được sử dụng để điều chế các khí 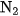 và
và 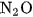 trong phòng thí nghiệm.
trong phòng thí nghiệm.
BÀI TẬP
1. Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh rằng amoniac tan nhiều trong nước.
2. Hoàn thành sơ đồ chuyển hoá sau đây và viết các phương trình hoá học :
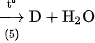
Biết rằng A là hợp chất của nitơ.
3. Hiện nay, để sản xuất amoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđ̛o và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.
Hãy viết các phương trình hoá học của phản ứng điều chế khí hiđro, loại khí oxi và tổng hợp khí amoniac.
4. Trình bày phương pháp hoá học để phân biệt các dung dịch : 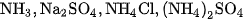 . Viết phương trình hoá học của các phản ứng đã dùng.
. Viết phương trình hoá học của các phản ứng đã dùng.
5. Muốn cho cân bằng của phản ứng tổng hợp amoniac chuyển dịch sang phải, cần phải đồng thời :
A. tăng áp suất và tăng nhiệt độ.
B. giảm áp suất và giảm nhiệt độ.
C. tăng áp suất và giảm nhiệt độ.
D. giảm áp suất và tăng nhiệt độ.
6. Trong phản ứng nhiệt phân các muối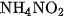 và
và 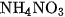 , số oxi hoá của nitơ biến đổi như thế nào ? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá ?
, số oxi hoá của nitơ biến đổi như thế nào ? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá ?
7. Cho dung dịch NaOH dư vào 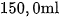 dung dịch
dung dịch 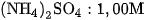
a) Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn.
b) Tính thể tích khí (đktc) thu được.
8. Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,0 gam
 ? Biết rằng hiệu suất chuyển hoá thành amoniac là 25,0 \% . Các thể tích khí được đo ở đktc.
? Biết rằng hiệu suất chuyển hoá thành amoniac là 25,0 \% . Các thể tích khí được đo ở đktc.A. 44,8 lít
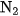 và 134,4 lít
và 134,4 lít 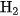
B. 22,4 lít
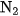 và 134,4 lít
và 134,4 lít 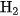
C. 22,4 lít
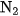 và 67,2 lít
và 67,2 lít 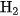
D. 44,8 lít
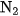 và 67,2 lít
và 67,2 lít 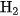















































Bình Luận
Để Lại Bình Luận Của Bạn