Nội Dung Chính
Biết được tính chất của cacbon liên quan như thế nào với cấu hình electron nguyên tứ của nó.
Biết được trạng thái tự nhiên, điều chế và ứng dụng của cacbon.
I - VỊ TRÍ VÀ CẤU HìNH ELECTRON NGUYÊN TỬ
Cacbon ở ô thứ 6 , nhóm IVA, chu kì 2 của bảng tuần hoàn.
Cấu hình electron của nguyên tử cacbon là 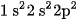
Các số oxi hoá của cacbon là -4,0,+2 và +4 .
II - TÍNH CHẤT VẬT LÍ
Nguyên tố cacbon có một số dạng thù hình là kim cương, than chì, fuleren, ... Chúng khác nhau về tính chất vật lí.
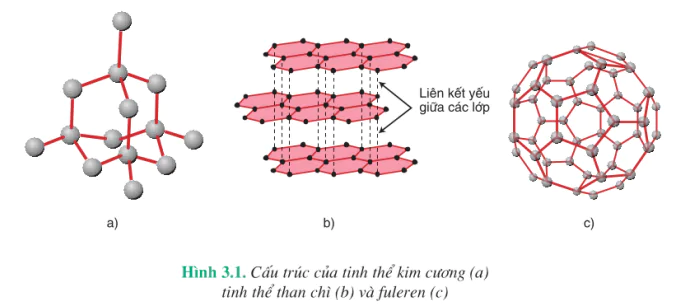
1. Kim cương
Kim cương là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. Trong tinh thể kim cương (hình 3.1a), mỗi nguyên tử cacbon liên kết với bốn nguyên tử cacbon lân cận nằm trên các đỉnh của hình tứ diện đều bằng bốn
liên kết cộng hoá trị bền. Mỗi nguyên tử cacbon nằm ở đỉnh lại liên kết với bốn nguyên tử cacbon khác. Do cấu trúc này mà kim cương rất cứng, là chất cứng nhất trong tất cả các chất.
2. Than chì
Than chì là chất tinh thể màu xám đen. Tinh thể than chì có cấu trúc lớp (hình 3.1 b). Trong một lớp, mỗi nguyên tử cacbon liên kết cộng hoá trị với ba nguyên tử cacbon lân cận nằm ở đỉnh của một tam giác đều. Các lớp lân cận liên kết với nhau bằng tương tác yếu, nên các lớp dễ tách khỏi nhau. Do cấu trúc này mà than chì mềm, khi vạch trên giấy nó để lại vạch đen gồm nhiều lớp tinh thể.
3. Fuleren
Fuleren gồm các phân tử 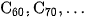 Phân tử
Phân tử 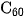 có cấu trúc hình cầu rỗng, gồm 32 mặt, với 60 đỉnh là 60 nguyên tử cacbon. Fuleren được phát hiện năm 1985.
có cấu trúc hình cầu rỗng, gồm 32 mặt, với 60 đỉnh là 60 nguyên tử cacbon. Fuleren được phát hiện năm 1985.
Các loại than điều chế nhân tạo như than gỗ, than xương, than muội, ... được gọi chung là cacbon vô định hình. Than gỗ, than xương có cấu tạo xốp, nên chúng có khả năng hấp phụ mạnh các chất khí và chất tan trong dung dịch.
III - TÍNH CHẤT HOÁ HỌC
Trong các dạng tồn tại của cacbon, cacbon vô định hình hoạt động hơn cả về mặt hoá học. Tuy nhiên, ở nhiệt độ thường cacbon khá trơ, còn khi đun nóng nó phản ứng được với nhiều chất.
Trong các phản ứng oxi hoá - khử, đơn chất cacbon có thể tăng hoặc giảm số oxi hoá, nên nó thể hiện tính khử hoặc tính oxi hoá. Tuy nhiên, tính khử vẫn là tính chất chủ yếu của cacbon.
1. Tính khử
a) Tác dụng với oxi
Cacbon cháy được trong không khí, phản ứng toả nhiều nhiệt :
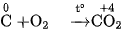
Ở nhiệt độ cao, cacbon lại khử được 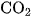
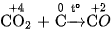
Do đó, sản phẩm khi đốt cacbon trong không khí, ngoài khí 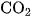 còn có một ít khí CO.
còn có một ít khí CO.
b) Tác dụng với hợp chất
Ở nhiệt độ cao, cacbon có thể khử được nhiều oxit, phản ứng với nhiều chất oxi hoá khác như 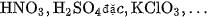
Thí du: 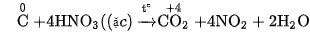
2. Tính oxi hoá
a) Tác dụng với hiđro
Ở nhiệt độ cao và có chất xúc tác, C tác dụng với khí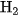
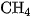 :
:
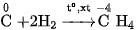
b) Tác dụng với kim loại
Ở nhiệt độ cao, C tác dụng được với một số kim loại tạo thành cacbua kim loại.
Thí dụ:
IV - ỨNG DỤNG
Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thuỷ tinh, làm bột mài.
Than chì được dùng làm điện cực, làm nồi để nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, làm bút chì đen.
Than cốc được dùng làm chất khử trong luyện kim, để luyện kim loại từ quặng. Than gỗ được dùng để chế tạo thuốc nổ đen, thuốc pháo, ...
Loại than có khả năng hấp phụ mạnh được gọi là than hoạt tính. Than hoạt tính được dùng trong mặt nạ phòng độc và trong công nghiệp hoá chất.
Than muội được dùng làm chất độn cao su, để sản xuất mực in, xi đánh giầy, ...
V - TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên, kim cương và than chì là cacbon tự do gần như tinh khiết. Ngoài ra, cacbon còn có trong các khoáng vật như canxit (đá vôi, đá phấn, đá hoa đều chứa 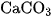 , magiezit
, magiezit 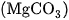 , dolomit
, dolomit 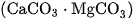
Nước ta có mỏ than antraxit lớn ở Quảng Ninh, một số mỏ than nhỏ hơn ở Thanh Hoá, Nghệ An, Quảng Nam, ...

VI - ĐIỀU CHẾ
Kim cương nhân tạo được điều chế từ than chì, bằng cách nung than chì ở khoảng 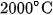 , dưới áp suất 50 đến 100 nghìn atmotphe với chất xúc tác là sắt, crom hay niken.
, dưới áp suất 50 đến 100 nghìn atmotphe với chất xúc tác là sắt, crom hay niken.
Than chì nhân tạo được điều chế bằng cách nung than cốc ở 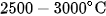 trong lò điện, không có mặt không khí.
trong lò điện, không có mặt không khí.
Than cốc được điều chế bằng cách nung than mỡ khoảng 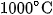 trong lò cốc, không có không khí.
trong lò cốc, không có không khí.
Than mỏ được khai thác trực tiếp từ các vỉa than nằm ở các độ sâu khác nhau dưới mặt đất.
Than gỗ được tạo nên khi đốt gỗ trong điều kiện thiếu không khí.
Than muội được tạo nên khi nhiệt phân metan có chất xúc tác :
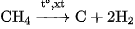
BÀI TẬP
1. Tại sao hầu hết các hợp chất của cacbon lại là hợp chất cộng hoá trị ?
2. Tính oxi hoá của cacbon thể hiện ở phản ứng nào trong các phản ứng sau ?
A. 
B. 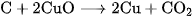
C. 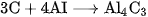
D. 
3. Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau ?
A. 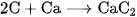
B. 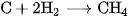
C.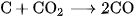
D.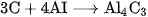
4. Lập phương trình hoá học của các phản ứng sau đây :
a) 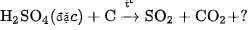
b) 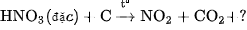
c) 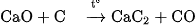
d) 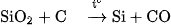
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 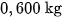 trong oxi dư, thu được
trong oxi dư, thu được 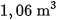 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
(đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.















































Bình Luận
Để Lại Bình Luận Của Bạn