Nội Dung Chính
(Trang 145)
MỤC TIÊU
- Nêu được khái niệm vé carboxylic acid.
- Viết được công thức cấu tạo và gọi tên một số acid theo danh pháp thay thế (C1-C5) và, một vài acid thường gặp theo tên thông thường.
- Trình bày được đặc điểm cấu tạo và hình dạng phân tử acetic acid.
- Nêu và giải thích được đặc điểm về tính chất vật lí (trạng thái, nhiệt độ sôi, tính tan) của carboxylic acid.
- Trình bày được tính chất hoá học cơ bản của carboxylic acid: Thể hiện tính acid (phản ứng với chất chỉ thị, phản ứng với kim loại, oxide kim loại, base, muối) và phản ứng ester hoá.
- Thực hiện được thí nghiệm về phản ứng của acetic acid (hoặc citric acid) với quỳ tím, sodium carbonate (hoặc calcium carbonate), magnesium; điều chế ethyl acetate (hoặc quan sát qua video thí nghiệm); mô tả được các hiện tượng thí nghiệm và giải thích được tính chất hoá học của carboxylic acid.
- Trình bày được ứng dụng của một số carboxylic acid thông dụng và phương pháp điều chế carboxylic acid (điều chế acetic acid bằng phương pháp lên men giấm và phản ứng oxi hoá alkane).
| Mở đầu Vị chua của giấm và các loại quả như khẽ, chanh, tảo, me,... đều được tạo bởi carboxylic acid. Vậy carboxylic acid chứa nhóm chức nào và có các tính chất đặc trưng gì? |
I. KHÁI NIỆM, DANH PHÁP
1. Khái niệm
| Hoạt động nghiên cứu Nhiều carboxylic acid tồn tại trong tự nhiên. Hãy nhận xét đặc điểm chung về cấu tạo của các carboxylic acid dưới đây:
HCOOH formic acid (có trong nọc kiến) CH3CH2CH2COOH butyric acid (có trong bơ) CH3COOH acetic acid (có trong giấm) COOH COOH oxalic acid (có trong quả khế) |
Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm -COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc –COOH) hoặc nguyên tử hydrogen.
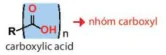
O
R
OH
n
carbonxylic acid
nhóm carboxyl
(Trang 146)
Công thức của các carboxylic acid đơn chức thường được viết ở dạng thu gọn là RCOOH.
Ví dụ: CH3COOH, CH2=CHCOOH, C6H5COOH.
2. Danh pháp
a) Danh pháp thay thế
Tên theo danh pháp thay thế của carboxylic acid đơn chức:
Ví dụ: 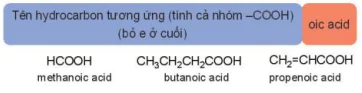
Tên hydrocarbon tương ứng (tính cả nhóm -COOH) (bỏ e ở cuối)
oic acid
HCOOH methanoic acid
CH3CH2CH2COOH butanoic acid
CH2=CHCOOH propenoic acid
Chú ý:
- Mạch chính là mạch carbon dài nhất chứa nhóm -COOH và được đánh số bắt đầu từ nhóm -COOH.
- Nếu mạch carbon có nhánh thì cần thêm vị trí và tên nhánh ở phía trước.
Ví dụ:
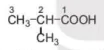
2-methylpropanoic acid
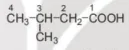
3-methylbutanoic acid
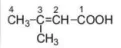
3-methylbut-2-enoic acid
b) Tên thông thường
Tên thông thường của carboxylic acid thường xuất phát từ nguồn gốc tìm ra chúng trong tự nhiên.
Bảng 24.1. Tên theo danh pháp thay thế, tên thông thường của một số carboxylic acid và nguồn gốc của tên gọi
| Công thức cấu tạo | Tên theo danh pháp thay thế | Tên thông thường | Nguồn gốc |
| HCOOH | methanoic acid | formic acid | formica (La-tinh): con kiến |
| CH3COOH | ethanoic acid | acetic acid | acetum (La-tinh): giấm ăn |
| CH3CH2COOH | propanoic acid | propionic acid | proion (Hy lạp): chất béo đầu tiên |
| CH3[CH2]14COOH | hexadecanoic acid | palmitic acid | paima (La-tinh): cây cọ |
| CH3[CH2]16COOH | octadecanoic acid | stearic acid | stear (Hy lạp): chất béo dạng rắn |
| C6H5COOH | phenylmethanoic acid | benzoic acid | benzoin: tên một loại nhựa cây |
| HOOC-COOH | ethanedioic acid | oxalic acid | oxalis: tên một chi của thực vật |
(Trang 147)
| CÂU HỎI VÀ BÀI TẬP 1. Viết các công thức cấu tạo và gọi tên theo danh pháp thay thế của các acid có công thức C4H9COOH. 2. Viết công thức cấu tạo của các carboxylic acid có tên gọi dưới đây: a) pentanoic acid; c) 2-methylbutanoic acid; b) but-3-enoic acid; d) 2,2-dimethylpropanoic acid. |
II. ĐẶC ĐIỂM CẤU TẠO
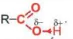
Nhóm carboxyl gồm có nhóm hydroxy (-O-H) liên kết với nhóm carbonyl 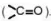 . Nhóm
. Nhóm 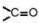 là nhóm hút electron nên liên kết O-H trong carboxylic acid phân cực hơn so với alcohol, phenol. Nhóm -COOH có thể phân li ra H⁺ nên tính chất hoá học đặc trưng của carboxylic acid là tính acid.
là nhóm hút electron nên liên kết O-H trong carboxylic acid phân cực hơn so với alcohol, phenol. Nhóm -COOH có thể phân li ra H⁺ nên tính chất hoá học đặc trưng của carboxylic acid là tính acid.

Hình 24.1. Cấu tạo nhóm carboxyl (a) và mô hình phân tử acetic acid (b)
III. TÍNH CHẤT VẬT LÍ
| Hoạt động nghiên cứu Tại sao trong các hợp chất hữu cơ có phân tử khối xấp xỉ nhau dưới đây, carboxylic acid có nhiệt độ sôi cao nhất?
|
Phân tử carboxylic acid chứa nhóm carboxyl phân cực. Các phân tử carboxylic acid liên kết hydrogen với nhau tạo thành dạng dimer hoặc dạng liên phân tử.
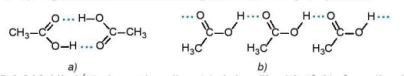
Hình 24.2. Liên kết hydrogen dạng dimer (a) và dạng liên phân tử (b) của acetic acid
(1) Nguồn: Organic chemistry: A Short Course, Harold Hart, Christopher M. Hadad, Leslie E. Craine, Cengage Learning, 2011.
(Trang 148)
Do vậy, carboxylic acid có nhiệt độ sôi cao hơn so với hydrocarbon, alcohol, hợp chất carbonyl có phân tử khối tương đương.
Carboxylic acid mạch ngắn là chất lỏng ở nhiệt độ phòng, carboxylic acid mạch dài là chất rắn dạng sáp. Carboxylic acid thường có mùi chua nồng.
Carboxylic acid mạch ngắn tan tốt trong nước. Khi tăng số nguyên tử carbon trong gốc hydrocarbon thì độ tan của các carboxylic acid giảm.
Bảng 24.2. Nhiệt độ sôi và tình tan của một số carboxylic acid(1)
| Công thức | Tên gọi | Nhiệt độ nóng chảy (°C) | Nhiệt độ sôi (°C) | Độ tan trong nước ở 25 °C (g/100 g) |
| HCOOH | methanoic acid | 8 | 101 | tan vô hạn |
| CH3COOH | ethanoic acid | 17 | 118 | tan vô hạn |
| CH3CH2COOH | propanoic acid | -22 | 141 | tan vô hạn |
| CH3[CH2]2OOH | butanoic acid | -8 | 164 | tan vô hạn |
| CH3[CH2]3OOH | pentanoic acid | -34 | 186 | 4,97 |
| CH3[CH2]4OOH | hexanoic acid | -1.5 | 205 | 1,0 |
| CH3[CH2]8OOH | decanoic acid | 31 | 270 | 0,01 |
IV. TÍNH CHẤT HOÁ HỌC
1. Tính acid
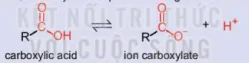
| Hoạt động nghiên cứu Trong dung dịch nước, carboxylic acid phân li không hoàn toàn theo cân bằng:
carboxylic acid ion cacboxylate Hằng số cân bằng của phương trình phân li một số carboxylic acid được cho trong Bảng 24.3. Bảng 24.3. Hằng số cân bằng của phương trình phân li một số carboxylic acid (1)
Hãy nhận xét về khả năng phân li của carboxylic acid. Chúng là các acid mạnh hay yếu và có các phản ứng đặc trưng nào? |
(1) Nguồn: Organic chemistry: A Short Course, Harold Hart, Christopher M. Hadad, Leslie E. Craine, Cengage Learning, 2011.
(Trang 149)
| Hoạt động thí nghiệm Thí nghiệm: Tính acid của acetic acid Chuẩn bị: dung dịch acetic acid 10%, dung dịch Na2CO3 10%, bột Mg; ống nghiệm, giấy quỳ. Tiến hành: 1. Phản ứng với chất chỉ thị: Nhỏ một giọt dung dịch acetic acid 10% lên mầu giấy quỳ. Quan sát và mô tả sự thay đổi màu sắc của giấy quỳ. 2. Phản ứng với kim loại: - Cho 1-2 mL dung dịch acetic acid 10% vào ống nghiệm (1). - Thêm tiếp một ít bột Mg vào ống nghiệm (1). Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (1). 3. Phản ứng với muối: - Cho 1-2 mL dung dịch Na2CO3 10% vào ống nghiệm (2). - Thêm tiếp 1 – 2 mL dung dịch acetic acid 10% vào ống nghiệm (2). Thực hiện yêu cầu sau: Quan sát và mô tả hiện tượng xảy ra trong ống nghiệm (2). Viết phương trình hoá học của các phản ứng xảy ra trong các thí nghiệm trên và giải thích hiện tượng. |
Trong dung dịch nước, chỉ một phần nhỏ carboxylic acid phân li thành ion, vì vậy carboxylic acid là những acid yếu. Chúng thể hiện đầy đủ tính chất của acid.
Ví dụ:
2CH3COOH + Zn → (CH3COO)2Zn + H2
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O +CO2
2CH3COOH + Ca(OH)2 → (CH2COO)2Ca + H2O
2CH3COOH + CuO → (CH3COO)2Cu + H2O
| CÂU HỎI VÀ BÀI TẬP 4. Viết phương trình hoá học phản ứng giữa acetic acid với các chất sau: a) Ca b) Cu(OH)2 c) CaO d) K2CO3 5. a) Khi có cặn màu trắng (thành phần chính là CaCO3) bám ở đáy ấm đun nước, vòi nước, thiết bị vệ sinh,... có thể dùng giấm để loại bỏ các vết cặn này. Hãy giải thích. b) Các đồ vật bằng đồng sau một thời gian đề trong không khí thường bị xỉn màu, dùng khăn tầm một ít giấm rồi lau các đồ vật này, chúng sáng bóng trở lại. Hãy giải thích. |
(1) Nguồn: Hóa học tổng quát, hữu cơ và sinh học, ấn bản thứ sáu, H. Stephen Stoker, Cengage Learning, 2013.
(Trang 150)
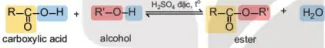
2. Phản ứng ester hoá
Carboxylic acid phản ứng với alcohol tạo thành ester và nước theo phản ứng:
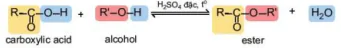
carbonxylic
alcohol
ester
Phản ứng giữa carboxylic acid và alcohol được gọi là phản ứng ester hoá. Phản ứng có đặc điểm thuận nghịch và thường dùng sulfuric acid đặc làm xúc tác.
Ví dụ: 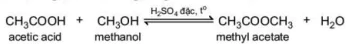
acetic acid
methanol
methyl acetate
| Hoạt động nghiên cứu Nghiên cứu phản ứng ester hoá – điều chế ethyl acetate Điều chế ethyl acetate trong phòng thí nghiệm được tiến hành như sau: - Cho khoảng 2 mL ethanol và 2 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp. - Thêm khoảng 1 mL dung dịch H2SO4 đặc, lắc nhẹ để các chất trộn đều với nhau. - Kẹp ống nghiệm vào kẹp gỗ rồi đặt ống nghiệm vào cốc nước nóng (khoảng 60 °C -70 °C) trong khoảng 5 phút, thình thoảng lắc đều hỗn hợp. Sau đó lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 5 mL dung dịch muối ăn bão hoà. Thực hiện yêu cầu: 1. Mô tả hiện tượng, viết phương trình hoá học của phản ứng ester hoá xảy ra trong thí nghiệm trên. 2. Vai trò của sulfuric acid trong thí nghiệm trên là gì? |
| EM CÓ BIẾT Nhiều hợp chất ester tạo nên mùi hương đặc trưng của các loại hoa quả. Ví dụ:
CH3CH2CH2COCH2CH3 (Dứa) CH3COOCH2CH2CH(CH3)2 (Chuối) CH3CH2COOCH3 (Táo) CH3COO[CH2]7CH3 (Cam) COOCH3 NH2 (Nho) |
V. ĐIỀU CHẾ
1. Phương pháp lên men giấm
Phương pháp lên men được sử dụng từ thời xa xưa đề làm giấm. Nguyên liệu thường là các loại rượu như rượu gạo, rượu táo, rượu vang,... Quá trình lên men nhờ vi khuẩn acetobacter (men giấm) chuyển hoá ethanol thành acetic acid bởi oxygen không khí.

2H5OH + O2
men giấm
CH3COOH + H2O
Trong công nghiệp, người ta cung cấp thêm oxygen đề tăng tốc độ phản ứng lên men.
2. Phương pháp oxi hoá alkane
Các alkane bị oxi hoá cắt mạch tạo thành các acid:
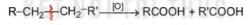
Ví dụ: 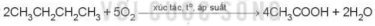
VI. ỨNG DỤNG
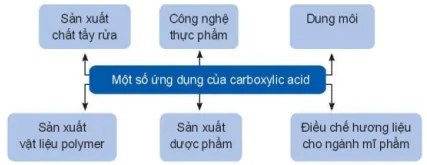
Một số ứng dụng của carboxylic acid
Sản xuất chất tẩy rửa
Công nghệ thực phẩm
Dung môi
Sản xuất vật liệu polymer
Sản xuất dược phẩm
Điều chế hương liệu cho ngành mĩ phẩm
| Hoạt động nghiên cứu Em hãy tìm hiểu và trình bày ứng dụng của một carboxylic acid. |
(Trang 152)
| EM ĐÃ HỌC Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm -COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc -COOH) hoặc nguyên tửhydrogen. Có thể biểu diễn công thức của carboxylic acid đơn chức dưới dạng RCOOH. Danh pháp thay thế của carboxylic acid đơn chức:
Tên hydrocarbon mạch chính (tính cả nhóm -COOH) (bỏ e ở cuối) axit oic
Nhóm -COOH có thể phân li thành H⁺ nên tính chất hoá học đặc trưng của carboxylic acid là tính acid.
Phản ứng ester hoá:
carboxylic acid alcohol ester
1. Phương pháp lên men giấm:
C2H5OH + O2 men giám, CH3COOH + H2O am 2. Phương pháp oxi hoá alkane
|
| EM CÓ THỂ Biết cách làm giấm bằng phương pháp lên men đề sử dụng trong gia đình. Vận dụng các tính chất của carboxylic acid đề giải thích các ứng dụng của chúng trong đời sống: tẩy cặn ở đáy ấm, loại bỏ các lớp gì bám trên bề mặt kim loại.... |




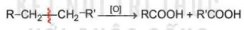








































































Bình Luận
Để Lại Bình Luận Của Bạn