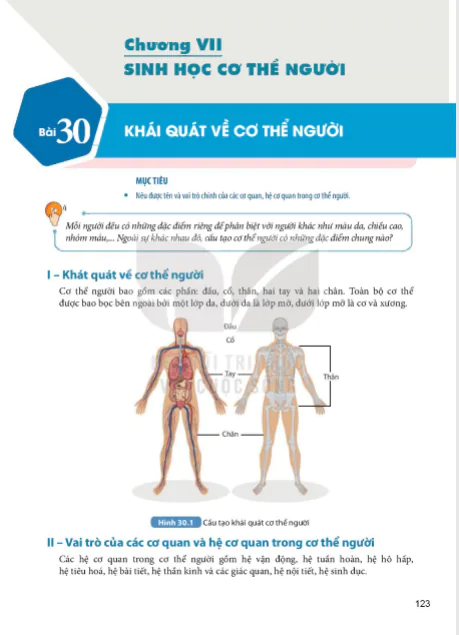
Nội Dung Chính
(Trang 16)
MỤC TIÊU
- Nêu được khái niệm mol, tính được khối lượng mol và chuyển đổi được giữa số mol và khối lượng.
- Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí và so sánh được chất khí này nặng hay nhẹ hơn chất khí khác, công thức tính tỉ khối.
- Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25 °C.
- Sử dụng được công thức n(mol) =
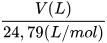 để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 °C.
để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 °C.
Bằng phép đo thông thường, ta chỉ xác định được khối lượng chất rắn, chất lỏng hoặc thể tích của chất khí. Làm thế nào để biết lượng chất có bao nhiêu phân tử, nguyên tử?
I-Mol
1. Khái niệm
Trong khoa học, khối lượng nguyên tử carbon được quy ước là đơn vị khối lượng nguyên tử (amu). Như vậy: khối lượng 1 nguyên tử carbon là 12 amu. Khối lượng này vô cùng nhỏ bé, không thể cân bằng các dụng cụ thông thường (khối lượng của 1 nguyên tử carbon tính theo đơn vị gam là 0,000 000 000 000 000 000 000 019 926 gam).
khối lượng nguyên tử carbon được quy ước là đơn vị khối lượng nguyên tử (amu). Như vậy: khối lượng 1 nguyên tử carbon là 12 amu. Khối lượng này vô cùng nhỏ bé, không thể cân bằng các dụng cụ thông thường (khối lượng của 1 nguyên tử carbon tính theo đơn vị gam là 0,000 000 000 000 000 000 000 019 926 gam).
Nhưng ta dễ dàng cân được 12 gam carbon. Các nhà khoa học đã tìm ra 12 gam carbon có chứa số nguyên tử là 602 200 000 000 000 000 000 000 = 6,022-1023. Số 6,022.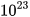 . Số 6,022.
. Số 6,022.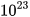 được gọi là số Avogadro, được kí hiệu là
được gọi là số Avogadro, được kí hiệu là 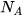 .
.
Mol là lượng chất có chứa 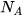
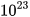 ) nguyên tử hoặc phân tử của chất đó.
) nguyên tử hoặc phân tử của chất đó. 
a) 12 gam carbon có 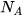 nguyên tử C hay 1 mol nguyên tử carbon
nguyên tử C hay 1 mol nguyên tử carbon
b) 254 gam iodine có 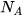 phân tử
phân tử 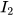
c) 18 gam nước có
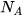 phân tử
phân tử 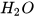 hay 1 mol phân tử nước
hay 1 mol phân tử nướcHình 3.1 Một số ví dụ lượng chất chứa
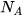 nguyên tử hoặc phân tử.
nguyên tử hoặc phân tử. (Trang 17)
1. Đọc thông tin Hình 3.1 và so sánh khối lượng của 1 mol nguyên tử carbon, 1 mol phân tử iodine và 1 mol phân tử nước.
2. Tính số nguyên tử, phân tử có trong mỗi lượng chất sau:
a) 0,25 mol nguyên tử C; b) 0,002 mol phân tử 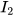 ; c) 2 mol phân tử
; c) 2 mol phân tử 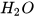
3. Một lượng chất sau đây tương đương bao nhiêu mol nguyên tử hoặc mol phân tử?
a) 1,2044.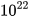 phân tử
phân tử 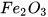 ; b) 7,5275.
; b) 7,5275.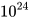 nguyên tử Mg.
nguyên tử Mg.
Số Avogadro lớn tới mức nào?
Để hình dung số Avogadro lớn tới mức nào, ta hãy thử một phép toán: giả sử ta có 1 mol quả cam được xếp sát nhau thành một đường thẳng, đường kính mỗi quả cam đều bằng 6 cm. Vậy chiều dài đường thẳng tạo thành từ 1 mol quả cam là: 6,022.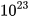 . 6 ≈ 36.
. 6 ≈ 36.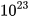
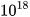 km.
km. Khoảng cách từ Trái Đất đến Mặt Trời là khoảng 150 - 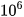 km. Như vậy, đường thẳng tạo thành từ 1 mol quả cam này sẽ gấp khoảng
km. Như vậy, đường thẳng tạo thành từ 1 mol quả cam này sẽ gấp khoảng 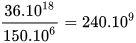 khoảng cách từ Trái Đất đến Mặt Trời.
khoảng cách từ Trái Đất đến Mặt Trời.
Có thể thấy số Avogadro vô cùng lớn. Vì vậy, nó chỉ được sử dụng đối với hạt vi mô.
2. Khối lượng mol
Khối lượng mol (kí hiệu là M) của một chất là khối lượng của 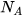 nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
Một số ví dụ về khối lượng mol nguyên tử và khối lượng mol phân tử được trình bày trong Bảng 3.1 và Bảng 3.2.
Bảng 3.1. Khối lượng một số nguyên tử và khối lượng mol nguyên tử tương ứng
| Nguyên tử | Kí hiệu hoá học | Khối lượng nguyên tử | Khối lượng mol nguyên tử |
| Carbon | C | 12 amu | 12 g/mol |
| Hydrogen | H | 1 amu | 1 g/mol |
| Oxygen | O | 16 amu | 16 g/mol |
Bảng 3.2. Khối lượng một số phân tử và khối lượng mol phân tử tương ứng
| Phân tử | Công thức hóa học | Số lượng nguyên tử trong phân tử | Khối lượng phân tử | Khối lượng mol phân tử |
| Hydrogen | 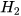 | 2 nguyên tử H | 2.1=2 (amu) | 2 g/mol |
| Nước | 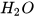 | 2 nguyên tử H, 1 nguyên tử O | 2.1+1.16=18 (amu) | 18 g/mol |
Khối lượng mol (g/mol) của một chất và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
Gọi n là số mol chất có trong m gam. Khối lượng mol (M) được tính theo công thức:
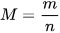 (g/mol)
(g/mol)
(Trang 18)
1. Tính khối lượng mol của chất X, biết rằng 0,4 mol chất này có khối lượng là 23,4 gam.
2. Tính số mol phân tử có trong 9 gam nước, biết rằng khối lượng mol của nước là 18 g/mol.
3. Calcium carbonate có công thức hoá học là 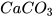
a) Tính khối lượng phân tử của calcium carbonate.
b) Tính khối lượng của 0,2 mol calcium carbonate.
3. Thể tích mol của chất khí
Thể tích mol của chất khí là thể tích chiếm bởi N, phân tử của chất khí đó.
Thể tích mol của các chất khí bất kì ở cùng điều kiện nhiệt độ và áp suất đều bằng nhau.
Như vậy, ở cùng điều kiện nhiệt độ và áp suất, hai bình khí có thể tích bằng nhau có cùng số mol khí.
Ở điều kiện chuẩn (25 °C và 1 bar), 1 mol khí bất kì đều chiếm thể tích là 24,79 lít.
Vậy ở điều kiện này, n mol khí chiếm thể tích là: V = 24,79 .n (L).
Thể tích mol của một số chất lỏng và chất rắn
Thể tích mol của một số chất rắn và chất lỏng ở 25 °C và 1 bar như sau:
Đồng (copper): 7,2 cm3/mol;
Nhôm (aluminium): 10,0 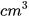 /mol;
/mol;
Nước lỏng: 18,0 cm3/mol;
Ethanol: 57,5 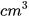
Thể tích mol của chất rắn và chất lỏng thường rất nhỏ so với thể tích mol của chất khí ở cùng điều kiện, ít phụ thuộc vào nhiệt độ và áp suất.
1. Ở 25 °C và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu?
2. Một hỗn hợp gồm 1 mol khí oxygen với 4 mol khí nitrogen. Ở 25 °C và 1 bar, hỗn hợp khí này có thể tích là bao nhiêu?
3. Tính số mol khí chứa trong bình có thể tích 500 mililít ở 25 °C và 1 bar.
II – Tỉ khối chất khí
Để xác định khí A nặng hơn hay nhẹ hơn khí B bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A (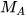 ) và khối lượng mol của khí B (
) và khối lượng mol của khí B (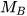 ). Tỉ số này được gọi là tỉ khối của khí A đối với khí B, được biểu diễn bằng công thức:
). Tỉ số này được gọi là tỉ khối của khí A đối với khí B, được biểu diễn bằng công thức: 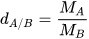
Để xác định một khí A nặng hơn hay nhẹ hơn không khí bao nhiêu lần, ta dựa vào tỉ số giữa khối lượng mol của khí A và “khối lượng mol” của không khí:
(Trang 19)
- Coi không khí gồm 20% oxygen và 80% nitrogen về thể tích. Vậy trong 1 mol không khí có 0,2 mol oxygen và 0,8 mol nitrogen. Khối lượng mol của không khí là:
 = 0,2.32 +0,8.28≈29 (g/mol)
= 0,2.32 +0,8.28≈29 (g/mol)
- Tỉ khối của khí A đối với không khí là: 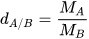
1. a) Khí carbon dioxide (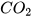 ) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
b) Trong lòng hang sâu thường xảy ra quá trình phân huỷ chất vô cơ hoặc hữu cơ, sinh ra khí carbon dioxide. Hãy cho biết khí carbon dioxide tích tụ ở trên nền hang hay bị không khí đẩy bay lên trên.
2. a) Khí methane (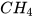 ) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
) nặng hơn hay nhẹ hơn không khí bao nhiêu lần?
b) Dưới đáy giếng thường xảy ra quá trình phân huỷ chất hữu cơ, sinh ra khí methane. Hãy cho biết khí methane tích tụ dưới đáy giếng hay bị không khí đẩy bay lên trên.
EM ĐÃ HỌC
- Mol là lượng chất có chứa
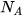 (6,022.
(6,022.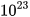 ) nguyên tử hoặc phân tử chất đó.
) nguyên tử hoặc phân tử chất đó. - Khối lượng mol của một chất là khối lượng của
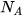 nguyên tử hoặc phân tử chất đó tính theo don vi gam.
nguyên tử hoặc phân tử chất đó tính theo don vi gam. - Thể tích mol của chất khí là thể tích chiếm bởi 1 mol phân tử chất khí đó.
- Tỉ khối của khí A đối với khí B là tỉ lệ khối lượng mol giữa khí A và khí B.
EM CÓ THỂ
- Cân hoặc đong một lượng chất có số mol xác định.
- Cảnh báo các nguy cơ mất an toàn khi nạo, vét giếng, thám hiểm hang động,...





































Bình Luận
Để Lại Bình Luận Của Bạn