Nội Dung Chính
(Trang 48)
MỤC TIÊU
- Nêu được khái niệm về muối, đọc được tên một số loại muối thông dụng và trình bày được một số phương pháp điều chế muối.
- Chỉ ra được một số muối tan và muối không tan từ bảng tính tan.
- Tiến hành được thí nghiệm muối phản ứng với kim loại, acid, base, muối; nêu và giải thích được hiện tượng xảy ra trong thí nghiệm và rút ra kết luận về tính chất hoá học của muối.
- Trình bày được mối quan hệ giữa acid, base, oxide và muối và rút ra được kết luận về tính chất hoá học của acid, base, oxide.
![]()
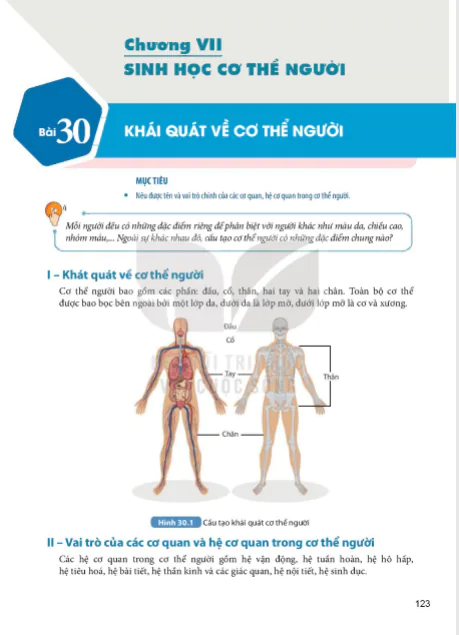
I- Khái niệm
Tìm hiểu về các phản ứng tạo muối
Bảng 11.1. Phản ứng tạo thành muối, tên gọi và thành phần phân tử của một số muối
| Phản ứng | Công thức phân tử của muối tạo thành và tên gọi | Thành phần phân tử của muối tạo thành | |
| Cation kim loại | Anion gốc acid | ||
| Kim loại + Acid →Muối +Hydrogen Zn + 2HCl → | Zinc chloride |  |  |
| Acid + Base → Muối + Nước
|
Copper (II) sulfate |  |  |
| Acid + Oxide base → Muối + Nước
|
Iron(II) sulfate |  |  |
Quan sát Bảng 11.1 và thực hiện các yêu cầu :
- Nhận xét về sự khác nhau giữa các thành phần phân tử của acid ( chất phản ứng ) và muối ( chất sản phẩm). Đặc điểm chung của các phản ứng ở Bảng 11.1 là gì ?
- Nhận xét về cách goị tên muối.
Muối là hợp chất, được tạo thành từ sự thay thế ion  của acid bằng ion kim loại hoặc ion ammonium (
của acid bằng ion kim loại hoặc ion ammonium (
Ví dụ:  (sodium sulfate);
(sodium sulfate);  (ammonium chloride)
(ammonium chloride)
Công thức phân tử của muối gồm có cation kim loại và anion gốc acid được gọi tên theo quy tắc sau:
Tên kim loại (hoá trị, đối với kim loại nhiều hoá trị) + tên gốc acid
(Trang 49)
Bảng 11.2. Tên gọi một số gốc acid
| Gốc acid | Tên gọi | Gốc acid | Tên gọi |
| -Cl | chloride | 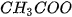 | acetate |
| -Br | bromide | =S | sulfide |
| -I | iodide | -HS | hydrogensulfide |
-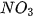 | nitrate | =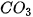 | carbonate |
=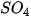 | sulfate | -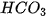 | hydrogencarbonate |
-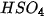 | hydrogensulfate | =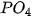 | phosphate |
=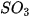 | sulfite | =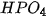 | hydrogenphosphate |
 Viết công thức của các muối sau : potassium sulfate, sodium hydrogensulfate, sodium hydrogencarbonate, sodium chloride, sodium nitrate, calcium hydrogenphosphate, magnesium sulfate, copper(II) sulfate.
Viết công thức của các muối sau : potassium sulfate, sodium hydrogensulfate, sodium hydrogencarbonate, sodium chloride, sodium nitrate, calcium hydrogenphosphate, magnesium sulfate, copper(II) sulfate.- Gọi tên các muối sau:
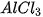 ,
, 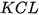 ,
, 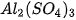 ,
,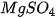 ,
, 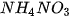 ,
, 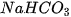 .
. - Viết phương trình hoá học của phản ứng tạo thành muối
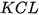 và
và 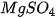 .
.
II – Tính tan của muối
Đa số các muối là chất rắn, có những muối không tan trong nước, có muối ít tan, có muối tan tốt trong nước. Người ta đã xây dựng bảng tính tan của các chất để tiện sử dụng.
Bảng 11.3. Bảng tính tan trong nước của một số muối
| Gốc acid | CÁC KIM LOẠI | |||||||||||
| K I | Na I | Ag I | Mg II | Ca II | Ba II | Zn II | Pb II | Cu II | Fe II | Fe III | Al III | |
| -Cl | t | t | k | t | t | t | t | i | t | t | t | t |
-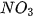 | t | t | t | t | t | t | t | t | t | t | t | t |
=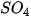 | t | t | i | t | i | k | t | k | t | t | t | t |
=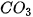 | t | t | k | k | k | k | k | k | - | k | - | - |
=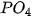 | t | t | k | k | k | k | k | k | k | k | k | k |
t : chất dễ tan trong nước. k : chất không tan( độ tan nhỏ hơn 0.01g/100g nước).
i : chất ít tan ( độ tan nhỏ hơn 1g/100g nước) (-) : chất không tồn tại hoặc bị nước phân huỷ.
(Trang 50)
III – Tính chất hoá học
Tìm hiểu tính chất hoá học của muối
Chuẩn bị : Các dung dịch: 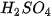
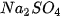 ,
, 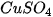 ; 4 ống nghiệm: ống (1) chứa 1 đinh sắt đã được làm sạch, ống (2) và (3) mỗi ống nghiệm chứa khoảng 1 mL dung dịch
; 4 ống nghiệm: ống (1) chứa 1 đinh sắt đã được làm sạch, ống (2) và (3) mỗi ống nghiệm chứa khoảng 1 mL dung dịch 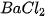 , ống (4) chứa khoảng 1 mL dung dịch
, ống (4) chứa khoảng 1 mL dung dịch 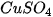 .
. Tiến hành: ống (1) cho khoảng 2 mL dung dịch 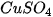
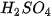 ; ống (3) cho khoảng 1 mL dung dịch
; ống (3) cho khoảng 1 mL dung dịch 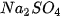 ; ống (4) cho khoảng 1 mL dung dịch NaOH.
; ống (4) cho khoảng 1 mL dung dịch NaOH.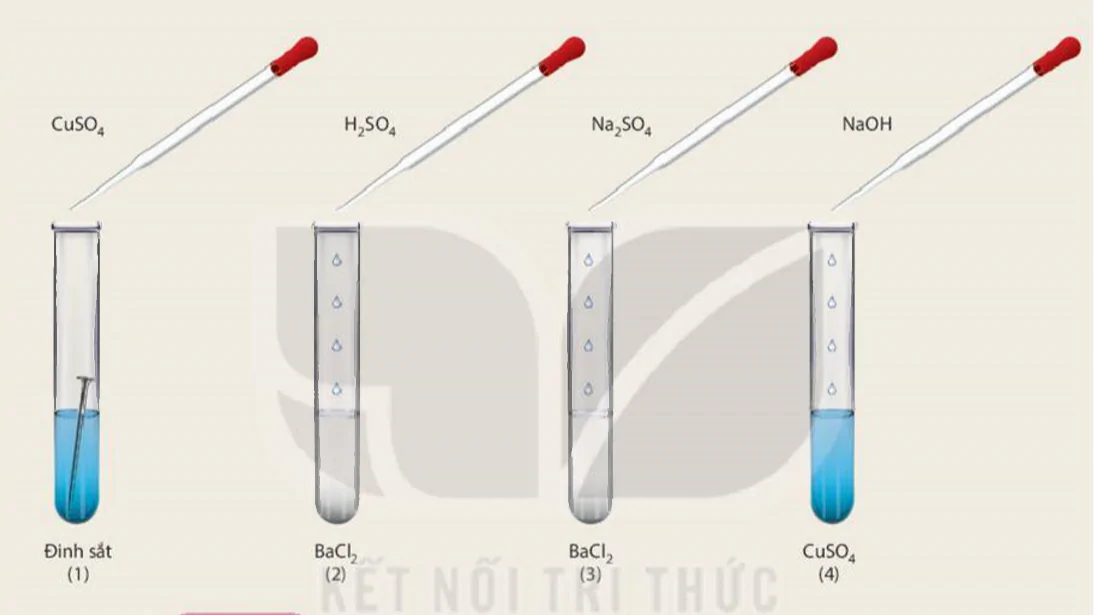
Hình 11.1 Mô tả thí nghiệm tìm hiểu về tính chất hoá học của muối
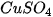
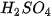
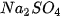 NaOH.
NaOH. (1) Đinh sắt (2) 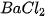 (3)
(3) 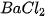 (4)
(4) 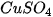
Quan sát hiện tượng xảy ra ở mỗi ống nghiệm và thực hiện yêu cầu:
1. Viết phương trình hoá học, giải thích hiện tượng xảy ra.
2. Thảo luận nhóm rút ra kết luận về tính chất hoá học của muối.
Một số tính chất chung của muối :
Dung dịch muối tác dụng với kim loại
Dung dịch mưới có thể tác dụng với một số kim loại tạo thành muối mới và kim loại mới.
Ví dụ : Zn + 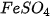
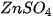 + Fe.
+ Fe. Muối tác dụng với dung dịch acid
Muối có thể tác dụng với một số dung dịch acid tạo thnhf muối mới và acid mới. Sản phẩm của phản úng tạo thành có ít nhất một chất là chất khí/chất ít tan/không tan,...
Ví dụ : 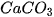 + 2HCl →
+ 2HCl → 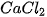 +
+ 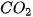 +
+ 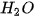
(Trang 51)
Dung dịch muối tác dụng với dung dịch base
Dung dịch muối tác dụng với dung dịch base tạo thành muối mới và base mới, trong đó có ít nhất một sản phẩm là chất khí/chất ít tan/không tan,...
Ví dụ: 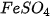 + 2NaOH →
+ 2NaOH → 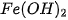 +
+ 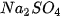 .
.
Dung dịch muối tác dụng với dung dịch muối
Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới, trong đó ít nhất có một muối không tan hoặc ít tan.
Ví dụ : 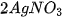 +
+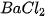
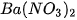
![]() Trong dung dịch, giữa các cặp chất nào sau đây có xảy ra phản ứng? Viết phương trình hoá học của các phản ứng đó.
Trong dung dịch, giữa các cặp chất nào sau đây có xảy ra phản ứng? Viết phương trình hoá học của các phản ứng đó.
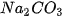 | KCl | 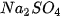 | 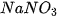 | |
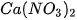 | ? | ? | ? | ? |
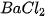 | ? | ? | ? | ? |
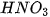 | ? | ? | ? | ? |
![]() Phản ứng trao đổi
Phản ứng trao đổi
Các phản ứng trong dung dịch giữa muối với acid, base, muối thuộc loại phản ứng trao đổi, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. Điều kiện để phản ứng trao đổi trong dung dịch xảy ra là sản phẩm tạo thành ít nhất một chất không tan/ chất khí,...
IV – Điều chế
- Muối có thể điều chế bằng một số phương pháp như sau:
- Dung dịch acid tác dụng với base. Ví dụ: HCl + NaOH → NaCl + 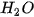
- Dung dịch acid tác dụng với oxide base. Ví dụ: 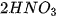 + CuO →
+ CuO →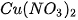 +
+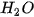 .
.
- Dung dịch acid tác dụng với muối. Ví dụ: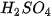 +
+ 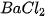
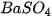 + 2HCl.
+ 2HCl.
- Oxide acid tác dụng với dung dịch base. Ví dụ: 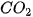 + 2NaOH →
+ 2NaOH → 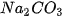 +
+ 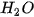 .
.
- Dung dịch muối tác dụng với dung dịch muối. Ví dụ: NaCl + 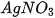
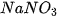 .
. ![]() Muối ăn được sản xuất từ nước biển bằng cách đưa nước biển vào ruộng. Để nước bốc hơi nhờ ánh nắng mặt trời, còn lại trên ruộng là muối.
Muối ăn được sản xuất từ nước biển bằng cách đưa nước biển vào ruộng. Để nước bốc hơi nhờ ánh nắng mặt trời, còn lại trên ruộng là muối.
Muối ăn cũng có thể được sản xuất từ muối mỏ.
V- Mối quan hệ giữa các hợp chất vô cơ
![]() Tính chất hoá học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây :
Tính chất hoá học của các hợp chất vô cơ được tóm tắt bằng sơ đồ dưới đây :
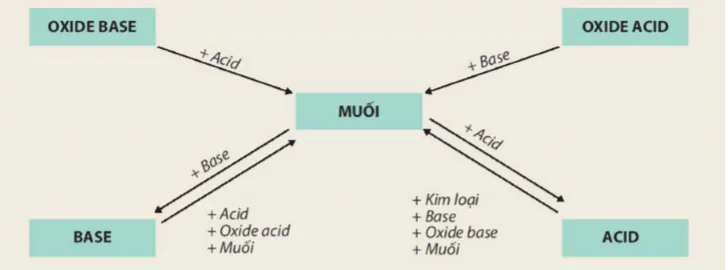
Hình 11.2 Sơ đồ biểu diễn mối quan hệ giữa các hợp chất vô cơ
OXIDE BASE OXIDE ACID
MUỐI
BASE ACID
+ Acid + Base
+ Base + Acid
+ Acid + Kim loại
+ Oxide acid + Base
+ Muối + Oxide base
+ Muối
Dựa vào sơ đồ Hình 11.2 và cho biết tính chất của oxide, acid, base. Viết phương trình hoá học minh hoạ.
EM ĐÃ HỌC
- Muối là hợp chất được hình thành từ sự thay thế ion
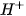 của acid bằng ion kim loại hoặc ion ammonium (
của acid bằng ion kim loại hoặc ion ammonium (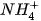 ).
). - Các muối có khả năng tan trong nước khác nhau, có muối tan nhiều, muối tan ít, muối không tan.
- Tên muối (chứa cation kim loại): tên kim loại (thêm hoá trị nếu kim loại có nhiều hóa trị) + tên gốc acid.
- Tính chất hoá học của muối : phản ứng với kim loại, acid, muối, base.
- Các hợp chất vô cơ có thể chuyển đổi hoá học thành các hợp chất vô cơ khác.
EM CÓ THỂ
Phân biệt được các loại hợp chất vô cơ nhờ các tính chất đặc trưng.
 +
+ 
 +
+  →
→  +
+ 
 +
+ 







































Bình Luận
Để Lại Bình Luận Của Bạn