Nội Dung Chính
(Trang 39)
MỤC TIÊU
- Nêu được khái niệm base (tạo ra ion OH-), kiếm là các hydroxide tan tốt trong nước.
- Tiến hành được các thí nghiệm của base (làm đổi màu chất chỉ thị, phản ứng với acid tạo muối); nêu và giải thích được hiện tượng xảy ra trong thí nghiệm (viết phương trình hoá học) và rút ra nhận xét vẽ tính chất của base.
- Tra được bảng tính tan để biết một hydroxide cụ thể thuộc loại kiếm hoặc base không tan.
- Nêu được thang pH, sử dụng pH để đánh giá độ acid – base của dung dịch.
- Tiến hành được một số thí nghiệm đo pH (bằng giấy pH) một số loại thực phẩm (đồ uống, hoa quả,..).
- Liên hệ được pH trong dạ dày, trong máu, trong nước mưa, đất.
Tại sao khi bị ong hoặc kiến đốt, người ta thường bôi vôi vào vết đốt?
I – Khái niệm
Tìm hiểu khái niệm base
Bảng 9.1. Tên một số base thông dụng, công thức hoá học và dạng tồn tại của base trong dung dịch
| Tên Base | Công thức hóa học | Dạng tồn tại của base trong dung dịch | |
| Cation kim loại | Anition | ||
| Sodium hydroxide | NaOH | Na+ | OH- |
| Barium hydroxide | 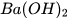 | 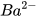 | OH- |
Quan sát Bảng 9.1 và thực hiện các yêu cầu:
1. Công thức hoá học của các base có đặc điểm gì giống nhau?
2. Các dung dịch base có đặc điểm gì chung?
3. Thảo luận nhóm và đề xuất khái niệm về base.
4. Em hãy nhận xét về cách gọi tên base và đọc tên base Ca(OH)
Tương tự acid, base cũng là một trong những hợp chất phổ biến.
Công thức phân tử của base gồm có một nguyên tử kim loại và một hay nhiều nhóm hydroxide (–OH). Số nhóm –OH bằng với hoá trị của kim loại.
Khái niệm về base được phát biểu như sau: Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
(Trang 40)
Hầu hết các hydroxide của kim loại là các base. Quy tắc gọi tên các base như sau:
Tên kim loại (kèm hoá trị đối với kim loại có nhiều hoá trị) + hydroxide
Ví dụ: 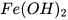 : iron(II) hydroxide;
: iron(II) hydroxide;
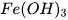 : iron(III) hydroxide.
: iron(III) hydroxide.
Phần lớn các base không tan trong nước (base không tan), một số ít base tan trong nước tạo thành dung dịch kiểm (base kiềm) như: KOH, NaOH, 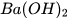 ,...
,...
Dựa vào bảng tính tan dưới đây, hãy cho biết những base nào là base không tan và base nào là base kiềm? Viết công thức hoá học và đọc tên các base có trong bảng.
| Kim loại | K | Na | Mg | Ba | Cu | Fe | Fe |
| Hóa trị | I | I | II | II | II | II | III |
| Nhóm -OH | t | t | k | t | k | k | k |
(Trong đó: t – tan; k— không tan)
II – Tính chất hoá học
Tính chất hoá học của base
Chuẩn bị: Dung dịch NaOH loãng, dung dịch HCl loãng, giấy quỳ tím, dung dịch phenolphthalein; ống nghiệm, ống hút nhỏ giọt.
Tiến hành:
Thí nghiệm 1: Nhỏ 1 – 2 giọt dung dịch NaOH vào mẫu giấy quỳ tím.
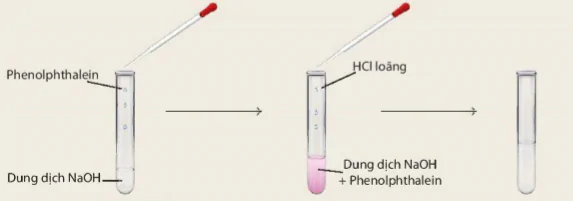
Thí nghiệm 2: Cho vào ống nghiệm khoảng 1 mL dung dịch NaOH loãng, sau đó nhỏ vào ống nghiệm 2 – 3 giọt dung dịch phenolphthalein. Dùng ống hút nhỏ giọt nhỏ từ từ dung dịch HCl vào hỗn hợp, vừa nhỏ vừa lắc (Hình 9.1).
Phenolphthalein
Dung dịch NaOH
HCI loäng
Dung dịch NaOH + Phenolphthalein
Hình 9.1. Phản ứng giữa dung dịch NaOH và dung dịch HCI
(Trang 41)
Quan sát hiện tượng và thực hiện các yêu cầu:
1. Dung dịch kiểm làm đổi màu chất chỉ thị màu (giấy quỳ tím, dung dịch phenolphthalein) như thế nào?
2. Nếu hiện tượng xảy ra ở thí nghiệm 2 và rút ra nhận xét.
Các base khác như KOH, 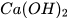 ,
, 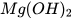 ,
, 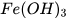 ,... cũng phản ứng với dung dịch acid tạo thành muối và nước.
,... cũng phản ứng với dung dịch acid tạo thành muối và nước.
Phản ứng của base với acid tạo thành muối và nước. Phản ứng này được gọi là phản ứng trung hoà.
Ví dụ: 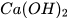 +
+ 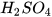
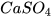 + 2
+ 2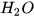 .
. Trong nọc của con ong và kiến có chứa các acid. Khi bôi vôi tôi (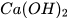 ) vào vết ong hoặc kiến đốt sẽ có tác dụng giảm đau do xảy ra phản ứng trung hoà acid và base.
) vào vết ong hoặc kiến đốt sẽ có tác dụng giảm đau do xảy ra phản ứng trung hoà acid và base.
1. Có hai ống nghiệm không nhãn đựng dung dịch NaOH và dung dịch HCl. Hãy nêu cách nhận biết hai dung dịch trên.
2. Ở nông thôn, người ta thường dùng vôi bột rắc lên ruộng để khử chua cho đất. Biết rằng thành phần chính của vôi bột là CaO. CaO tác dụng với 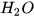 tạo thành
tạo thành 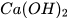
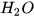 —
— 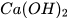 . Hãy giải thích tác dụng của vôi bột.
. Hãy giải thích tác dụng của vôi bột. Sodium hydroxide là base có nhiều ứng dụng trong sản xuất và đời sống (Hình 9.2).
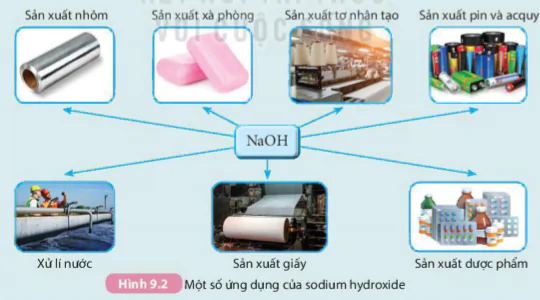
Sản xuất nhôm Sản xuất xà phòng Sản xuất tơ nhân tạo Sản xuất pin và acquy
Xử lí nước Sản xuất giấy Sản xuất dược phẩm
Hình 9.2 Một số ứng dụng của sodium hydroxide
(Trang 42)
III - Thang pH
Thang pH là một tập hợp các con số có giá trị từ 1– 14 được sử dụng để đánh giá độ acid – base của dung dịch. Các dung dịch acid có giá trị pH nhỏ hơn 7, các dung dịch kiểm có giá trị pH lớn hơn 7 và dung dịch trung tính có giá trị pH bằng 7.
Ngoài ra giá trị pH còn có thể được sử dụng để so sánh độ mạnh của các acid cùng nồng độ hoặc các base cùng nồng độ. Ví dụ, hydrochloric acid HCl 0,1 M có pH = 1; acetic acid 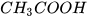 0,1 M có pH ≈ 3 nên hydrochloric acid mạnh hơn acetic acid.
0,1 M có pH ≈ 3 nên hydrochloric acid mạnh hơn acetic acid.
pH của một dung dịch có thể được xác định bằng chất chỉ thị màu vạn năng. Chất chỉ thị màu vạn năng là hỗn hợp các chất màu (ở dạng dung dịch hoặc giấy pH). Mỗi màu của chất chỉ thị ứng với một khoảng giá trị pH. Khi cần xác định giá trị pH với độ chính xác cao, người ta sử dụng các thiết bị đo pH như: máy đo pH, bút đo pH,...

Hình 9.3 Giấy pH
Xác định pH của một số dung dịch bằng giấy pH
Chuẩn bị: Các cốc đã được dán nhãn: nước lọc, nước chanh, nước ngọt có gas, nước rửa bát, giấm ăn, dung dịch baking soda, giấy pH; ống hút nhỏ giọt, đĩa thuỷ tinh.
Tiến hành:
- Cho 6 mẫu giấy pH dài khoảng 1 cm lên đĩa thuỷ tinh.
- Nhỏ lên mỗi mẩu giấy pH một loại dung dịch đã chuẩn bị ở trên.
- So sánh màu thu được trên các mẩu giấy pH với bảng màu dãy pH chuẩn và ghi giá tri pH.
Thực hiện các yêu cầu sau:
1. Đọc giá trị pH của từng dung dịch và cho biết dung dịch nào có tính acid, dung dịch nào có tính base.
2. Tính chất chung của dung dịch các chất có giá trị pH < 7 và của dung dịch các chất có giá trị pH > 7 là gì?
(Trang 43)
1. Hãy nêu cách để kiểm tra đất trồng có bị chua hay không.
2. Hãy tìm hiểu và cho biết giá trị pH trong máu, trong dịch dạ dày của người, trong nước mưa, trong đất. Nếu giá trị pH của máu và của dịch dạ dày ngoài khoảng chuẩn sẽ gây nguy hiểm cho sức khoẻ của người như thế nào?
EM ĐÃ HỌC
- Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
- Dung dịch base làm giấy quỳ tím chuyển sang màu xanh, dung dịch phenolphthalein không màu chuyển sang màu hồng. Phản ứng giữa dung dịch acid và base tạo thành muối và nước được gọi là phản ứng trung hoà.
- Theo thang pH: dung dịch có pH < 7: môi trường acid; dung dịch có pH > 7: môi trường base; dung dịch có pH = 7: môi trường trung tính.
EM CÓ THỂ
- Sử dụng giấy pH để đánh giá độ acid, base của các dung dịch, môi trường đất, nước,... phục vụ cho sản xuất, đời sống và chăm sóc sức khoẻ.








































Bình Luận
Để Lại Bình Luận Của Bạn