Nội Dung Chính
(Trang 20)
MỤC TIÊU
- Nêu được dung dịch là hỗn hợp đồng nhất của các chất đã tan trong nhau.
- Nêu được định nghĩa độ tan của một chất trong nước, nồng độ phần trăm, nồng độ mol.
- Tính được độ tan, nồng độ phần trăm; nồng độ mol theo công thức.
- Tiến hành được thí nghiệm pha một dung dịch theo một nồng độ cho trước.
Các dung dịch thường có ghi kèm theo nồng độ xác định như nước muối sinh lí 0,9%, sulfuric acid 1 mol/L,... Vậy nồng độ dung dịch là gì?
I - Dung dịch, chất tan và dung môi
Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi. Trong thực tế, dung môi thường là nước ở thể lỏng, chất tan có thể ở thể rắn, lỏng hoặc khí. Ở nhiệt độ, áp suất nhất định, dung dịch có thể hoà tan thêm chất tan đó được gọi là dung dịch chưa bão hoà, dung dịch không thể hoà tan thêm chất tan đó được gọi là dung dịch bão hoà.
Nhận biết dung dịch, chất tan và dung môi
Chuẩn bị: nước, muối ăn, sữa bột (hoặc bột sắn, bột gạo,...), copper(II) sulfate; cốc thuỷ tinh, đũa khuấy.
Tiến hành:
- Cho khoảng 20 mL nước vào bốn cốc thuỷ tinh, đánh số (1), (2), (3) và (4).
- Cho vào cốc (1) 1 thìa (khoảng 3 g) muối ăn hạt, cốc (2) 1 thìa copper(II) sulfate, cốc (3) 1 thìa sữa bột, cốc (4) 4 thìa muối ăn. Khuấy đều khoảng 2 phút, sau đó để yên.

Hình 4.1 Cốc chứa hỗn hợp nước và các chất rắn khác nhau
Quan sát và trả lời câu hỏi:
1. Trong các cốc (1), (2), (3), cốc nào chứa dung dịch? Dựa vào dấu hiệu nào để nhận biết? Chỉ ra chất tan, dung môi trong dung dịch thu được.
2. Phần dung dịch ở cốc (4) có phải là dung dịch bão hoà ở nhiệt độ phòng không? Giải thích.
Hãy nêu cách pha dung dịch bão hoà của sodium carbonate (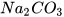 ) trong nước.
) trong nước.
(Trang 21)
II – Độ tan
Trong cùng điều kiện về nhiệt độ và áp suất, khả năng tan trong cùng một dung môi của các chất là khác nhau. Với cùng một lượng dung môi xác định, những chất tan tốt cần lượng lớn chất tan để tạo dung dịch bão hoà, còn những chất tan kém chỉ cần một lượng nhỏ chất tan đã thu được dung dịch bão hoà. Để đặc trưng cho khả năng tan của mỗi chất, người ta dùng khái niệm độ tan.
Độ tan của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở nhiệt độ, áp suất xác định.
Độ tan của một chất trong nước được tính theo công thức: 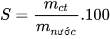
Trong đó: S là độ tan, đơn vị g/100 g nước;
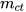 là khối lượng chất tan, đơn vị là gam (g);
là khối lượng chất tan, đơn vị là gam (g);
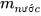 là khối lượng nước, đơn vị là gam (g).
là khối lượng nước, đơn vị là gam (g).
Độ tan của hầu hết các chất rắn như đường, muối ăn,... đều tăng khi nhiệt độ tăng.
| 1. Ở nhiệt độ 25 °C, khi cho 12 gam muối X vào 20 gam nước, khuấy kĩ thì còn lại 5 gam muối không tan. Tính độ tan của muối X. 2. Ở 18 °C, khi hoà tan hết 53 gam 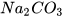 trong nước ở nhiệt độ trên. trong nước ở nhiệt độ trên. | Ngày nóng, cá thường ngoi lên phía mặt nước để hô hấp vì độ tan của oxygen trong nước đã bị giảm đi khi nhiệt độ tăng. Trong sản xuất nước ngọt có gas, người ta nén khí carbon dioxide ở áp suất cao để tăng độ tan của khí này trong nước. Nói chung, độ tan của hầu hết chất khí giảm khi nhiệt độ tăng hoặc áp suất giảm. |
III – Nồng độ dung dịch
Để định lượng một dung dịch đặc hay loãng, người ta dùng đại lượng nồng độ. Có hai loại nồng độ dung dịch thường dùng là nồng độ phần trăm và nồng độ mol.
1. Nồng độ phần trăm
Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
Nồng độ phần trăm được xác định bằng biểu thức: C% =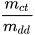 .100(%).
.100(%).
Trong đó: C% là nồng độ phần trăm của dung dịch, đơn vị %;
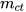 là khối lượng chất tan, đơn vị là gam (g);
là khối lượng chất tan, đơn vị là gam (g);
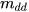 là khối lượng dung dịch, đơn vị là gam (g).
là khối lượng dung dịch, đơn vị là gam (g).
Khối lượng dung dịch = khối lượng chất tan + khối lượng dung môi.
Ví dụ: Dung dịch nước oxy già chứa chất tan hydrogen peroxide (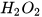
(Trang 22)
Hướng dẫn giải:
Khối lượng hydrogen peroxide có trong 20 gam dung dịch nước oxy già 3%:
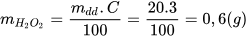
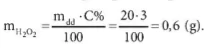
2. Nồng độ mol
Nồng độ mol (kí hiệu 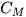 ) của một dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
) của một dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
Nồng độ mol được xác định bằng biểu thức: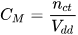
Trong đó: 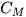
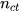 là số mol chất tan, đơn vị là mol;
là số mol chất tan, đơn vị là mol;
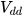 là thể tích dung dịch, đơn vị là lít (L).
là thể tích dung dịch, đơn vị là lít (L).
Ví dụ: Hoà tan hoàn toàn 1,35 gam copper(II) chloride vào nước, thu được 50 mL dung dịch. Tính nồng độ mol của dung dịch copper(II) chloride thu được.
Hướng dẫn giải:
Bước 1: Tính số mol chất tan.
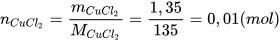
Bước 2: Tính nồng độ dung dịch copper(II) chloride.
Đổi đơn vị: 50 mL = 0,05 L.
Nồng độ mol dung dịch copper(II) chloride là:
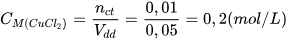
1. Tính khối lượng 
 98%.
98%. 2. Trộn lẫn 2 lít dung dịch urea 0,02 M (dung dịch A) với 3 lít dung dịch urea 0,1 M (dung dịch B), thu được 5 lít dung dịch C.
a) Tính số mol urea trong dung dịch A, B và C.
b) Tính nồng độ mol của dung dịch C. Nhận xét về giá trị nồng độ mol của dung dịch C so với nồng độ mol của dung dịch A, B.
IV – Thực hành pha chế dung dịch theo một nồng độ cho trước
Pha 100 gam dung dịch muối ăn nồng độ 0,9%
Chuẩn bị: muối ăn khan, nước cất; cốc thuỷ tinh, cân, ống đong.
(Trang 23)
Tiến hành:
- Xác định khối lượng muối ăn (m,) và nước (m,) dựa vào công thức:
C%=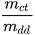 .100(%)
.100(%)
- Cân 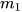 gam muối ăn rồi cho vào cốc thuỷ tinh.
gam muối ăn rồi cho vào cốc thuỷ tinh.
- Cân 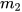 gam nước cất, rót vào cốc, lắc đều cho muối tan hết.
gam nước cất, rót vào cốc, lắc đều cho muối tan hết.
Trả lời câu hỏi:
1. Tại sao phải dùng muối ăn khan để pha dung dịch?
2. Dung dịch muối ăn nồng độ 0,9% có thể được dùng để làm gì?
Oresol (viết tắt của Oral Rehydration Solution) là một loại dung dịch có tác dụng bù nước và điện giải. Trong Oresol có một số thành phần chính là: sodium chloride, sodium bicarbonate, potassium chloride, glucose. Nồng độ các chất trong một loại dung dịch Oresol được WHO và UNICEF khuyên dùng là ion sodium: 0,075 mol/L; ion chloride: 0,065 mol/L; ion potassium: 0,020 mol/L; ion citrate: 0,010 mol/L; glucose: 0,075 mol/L,...
EM ĐÃ HỌC
- Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
- Độ tan của một chất trong nước:
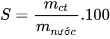
(S là độ tan, 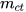 là khối lượng chất tan,
là khối lượng chất tan, 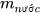 là khối lượng nước).
là khối lượng nước).
- Nồng độ phần trăm: C% =
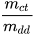 .100%
.100%
(C% là nồng độ phần trăm, 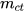 là khối lượng chất tan,
là khối lượng chất tan, 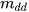
- Nồng độ mol:
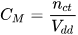
(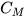 là nồng độ mol,
là nồng độ mol, 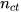 là số mol chất tan,
là số mol chất tan, 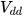 là thể tích dung dịch).
là thể tích dung dịch).
EM CÓ THỂ
- Pha chế một dung dịch có nồng độ xác định để làm thí nghiệm.
- Pha chế dung dịch nước muối 0,9% (có thể dùng thay nước muối sinh lí trong một số trường hợp).






































Bình Luận
Để Lại Bình Luận Của Bạn